
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质(A、B、C、D)的物质的量变化如图M所示,对该反应的推断合理的是( ) 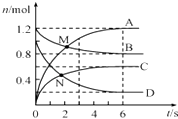
A.M点表示v(A)=v(B)
B.0~6s内,v(A):v(B):v(C):v(D)=3:1:1.5:2
C.反应进行到6s时,各物质的物质的量浓度相等
D.反应进行到6s时,C的平均反应速率为 0.1molL﹣1s﹣1
【答案】B
【解析】解:A.M点表示n(A)=n(B),速率不等,故A错误;
B.A、B、C、D的△n之比为(1.2﹣0):(1.2﹣0.8):(0.6﹣0):(1﹣0.2)=3:1:1.5:2,则0~6s内,v(A):v(B):v(C):v(D)=3:1:1.5:2,故B正确;
C.反应进行到6s时,各物质的物质的量浓度不变,且不相等,故C错误;
D.反应进行到6s时,C的平均反应速率为 ![]() =0.05molL﹣1s﹣1,故D错误;
=0.05molL﹣1s﹣1,故D错误;
故选B.
【考点精析】关于本题考查的化学平衡的计算,需要了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.


科目:高中化学 来源: 题型:
【题目】X、Y两元素可形成XY3型共价化合物,则X、Y最外层的电子排布可能是( )
A. X:3s23p2 Y:3s23p5 B. X:2s22p3 Y:2s22p4
C. X:3s23p1 Y:2s22p5 D. X:2s22p3 Y:1s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的硫酸亚铁、较多的Cu2+和较少的Na+以及部分泥沙.为了减少污染并变废为宝,工厂计划从该废水中回收绿矾和金属铜.请根据如图流程图完成实验方案.
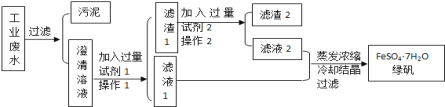
(1)操作1的名称___________.所需的玻璃仪器有_____________________
(2)已知试剂1为Fe,试剂2为稀硫酸,则滤渣2所含物质的化学式为__________
(3)在澄清溶液中加入试剂1后发生化学反应,请写出该反应的离子方程式____________.
(4)滤渣1中加入试剂2后发生化学反应,请写出该反应的离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌﹣空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH﹣+2H2O═2Zn(OH) ![]() .下列说法正确的是( )
.下列说法正确的是( )
A.充电时,电解质溶液中K+向阳极移动
B.放电时,电解质溶液中K+向正极移动
C.充电时,阳极反应为:Zn(OH) ![]() +2e﹣═Zn+4OH﹣
+2e﹣═Zn+4OH﹣
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镀作为一种新兴材料日益被重视,有“超级金属…尖端金属…空间金属”之称。工业上常用绿柱石(主要成分3BeO.Al2O3·6SiO2,还含有铁等杂质)冶炼铍,一种简化的工艺流程如下:
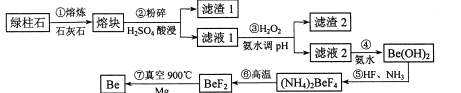
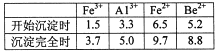
按元素周期表的对角线规则,Be和Al性质相似;几种金属阳离子的氢氧化物沉淀时的pH如表。回答下列问题:
(1)步骤②中将熔块粉碎的目的是_____________;滤渣1的主要成分是________。
(2)步骤③加入H2O2时发生反应的离子方程式为__________,从滤液1中得到沉淀的合理pH为__________(填序号)。
A 3.3-3.7 8 3.7—5.0 C 5.0~5.2 D.5.2—6.5
(3)步骤④不宜使用NaOH溶液来沉淀Be2+的原因是_____________。从溶液中得到(NH4)2BeF4的实验操作是_______、过滤、洗涤、干燥。
(4)步骤⑥的反应类型是_______,步骤⑦需要隔绝空气的环境,其原因是_____________。
(5)若绿柱石中Be0的含量为a%,上述过程生产Be的产率为b%,则1t该绿柱石理论上能生产含铍量2%的镀铜合金_______t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t°C时AgCl的Ksp=4×10﹣10 , 下列说法不正确的是( ) 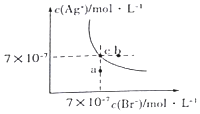
A.图中a点对应的是AgBr的不饱和溶液
B.在t°C时,AgBr的Ksp为 4.9×10﹣13
C.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
D.在t°C时,AgCl(s)+Br﹣(aq)AgBr(s)+Cl﹣(aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的恒容密闭容器中,可逆反应2NO2(g)![]() 2NO(g)+ O2(g)达到平衡状态的标志是
2NO(g)+ O2(g)达到平衡状态的标志是
①2V(O2)=V(NO2)
②单位时间内生成n molO2的同时生成2n molNO2
③NO2、NO、O2的浓度之比为2∶2∶1
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变
A.②④⑥ B.①④⑥ C.②④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子的吸收光谱是线状的而不是连续的,主要原因是( )
A. 原子中电子的能量高低 B. 外界条件的影响
C. 原子轨道的能量是量子化的 D. 仪器设备的工作原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,只有极少数能量比平均能量高得多的反应物分子发 生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用 kJ/mol 表示。请认真观察下图,然后 回答问题。
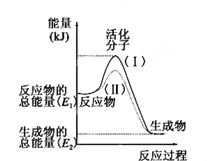
(1)图中所示反应是_____(填“吸热”或“放热”)反应。
(2)已知拆开 1mol H—H 键、1mol I—I、1mol H—I 键分别需要吸收的能量为 436kJ、151kJ、299kJ。则由 1mol 氢气和 1mol 碘反应生成 HI 会_____(填“放出”或“吸 收”)______kJ 的热量。在化学反应过程中,是将_____转化为_________。
(3)下列反应中,属于放热反应的是_____,属于吸热反应的是_____。
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳
⑤食物因氧化而腐败 ⑥Ba(OH)2·8H2O 与 NH4Cl 反应 ⑦铁粉与稀盐酸反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com