
| A. | ⅡA | B. | ⅡB | C. | ⅤⅡ | D. | ⅠB |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 由非金属元素组成的化合物不一定是共价化合物 | |
| B. | 离子化合物可能含共价键,共价化合物可能含离子键 | |
| C. | 任何单质中一定含共价键 | |
| D. | 离子键的本质就是阴阳离子间的静电引力 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
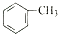 ;b.CH≡CCH3; c、
;b.CH≡CCH3; c、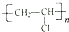
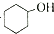 和
和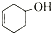 ,可选用b(填字母)
,可选用b(填字母)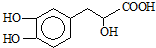
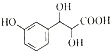 )与足量溴水反应所得产物的结构简式为
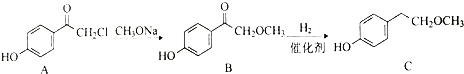
)与足量溴水反应所得产物的结构简式为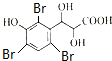 .
.
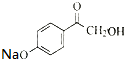 .
.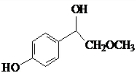 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Na2O2与足量的水反应,转移的电子数为2NA | |
| B. | 17g羟基中含有的电子数为10NA | |
| C. | 标准状况下,1mol已烷中共价键数目为19NA | |
| D. | 1L 0.10mol•L-1的Na2CO3溶液中阴离子数目之和小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
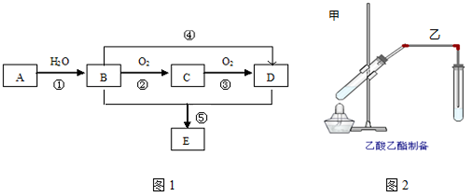
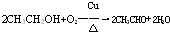 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com