
| A. | 10 | B. | 15 | C. | 20 | D. | 25 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
 | 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀, 4.黄绿色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(Fe)----加盐酸,过滤 | B. | NaCl溶液(碘)----CCl4,萃取、分液 | ||
| C. | KCl溶液(KNO3)----降温结晶,过滤 | D. | Cl2(HCl)----饱和氯化钠溶液,洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
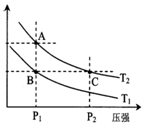 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 决定反应速率的主要因素有浓度、压强、温度 | |
| B. | 容量瓶、量筒个滴定管上都标有使用温度,容量瓶无“0”刻度,量筒、滴定管有“0”刻度;实验时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| C. | 为实验安全,金属钠切割下来的表层物质反应放回原试剂瓶,不能再研磨氯酸钾或硝酸钾 | |
| D. | 皂化反应结束后的混合液中加入饱和食盐水,再通过分液操作分离出硬质酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,气体颜色加深,则此反应为吸热反应 | |
| B. | 慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅 | |
| C. | 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍 | |
| D. | 恒温恒容时,充入惰性气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com