
| m |
| M |
| n |
| V |
| m |
| M |
| 5.3g |
| 106g/mol |
| n |
| V |
| 0.05mol |
| 0.1L |


科目:高中化学 来源: 题型:
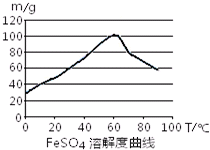 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.用铁屑与硫酸反应制备FeSO4
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.用铁屑与硫酸反应制备FeSO4| n(Fe) |
| n(H2SO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
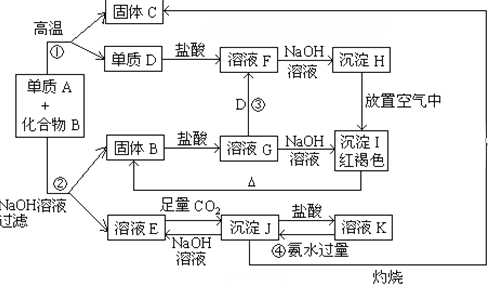
查看答案和解析>>
科目:高中化学 来源: 题型:
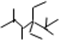 表示的分子名称是
表示的分子名称是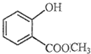 中含有的含氧官能团的名称为
中含有的含氧官能团的名称为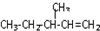 一定条件发生加聚反应时的化学方程式
一定条件发生加聚反应时的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
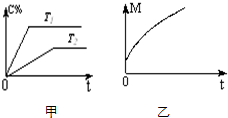 在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g)?p C(g)+q D(g).
在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g)?p C(g)+q D(g).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com