
| A. | 原电池负极发生氧化反应 | |
| B. | 原电池工作时溶液中的阳离子向正极移动 | |
| C. | 原电池工作时电子由负极沿导线流向正极,再经电解质溶液流回负极 | |
| D. | 原电池反应一定属于氧化还原反应 |
分析 A、原电池中正极发生还原反应,负极发生氧化反应,
B、原电池中,溶液中的阳离子向正极移动;
C、原电池中电子由负极流出,经导线流向正极;
D、原电池是将化学能转化为电能的装置,反应中一定伴随电子的转移.
解答 解:A、原电池中正极发生还原反应,负极发生氧化反应,故A正确,
B、原电池中,溶液中的阳离子向正极移动,阴离子向负极移动,故B正确;
C、原电池中电子由负极流出,经导线流向正极,电子不会经过电解质,故C错误;
D、原电池是将化学能转化为电能的装置,反应中一定伴随电子的转移,原电池反应一定属于氧化还原反应,故D正确.
故选C.
点评 本题考查原电池工作原理,比较基础,注意对基础知识的理解掌握,侧重于电极反应和电子流向的考查.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
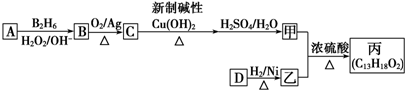
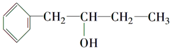 的同系物.
的同系物. .
. ,该反应的类型是取代反应.
,该反应的类型是取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水中溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 与相同浓度的盐酸反应的速度:Na2CO3>NaHCO3 | |
| D. | Na2CO3与NaHCO3相互转化的反应是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol甲基(-CH3)中含有7NA个电子 | |
| B. | 1L 0.5mol•L-1的(NH4)2SO4溶液中含有NA个NH4+ | |
| C. | 在铜与硫的反应中,1mol铜失去的电子数为NA | |
| D. | 36g C5H12分子中含有8NA个共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和② | B. | ②和③ | C. | 只有④ | D. | 只有③ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,活泼金属从盐酸中置换出1molH2,发生转移的电子数为2NA | |
| B. | 在常温常压下11.2L氯气所含的原子数目为NA | |
| C. | 在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA | |
| D. | 62gNa2O溶于水后所得溶液中含有O2-离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 悬浊液 | B. | 乳浊液 | C. | 胶体 | D. | 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
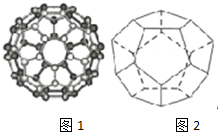 碳是最早被发现和利用的元素之一,长期以来人们以为单质碳的同素异形体只有精钢石、石墨、和无定型碳三种,1985年C60的发现将人类领入认识碳的全新领域--富勒烯,美国科学家Curl和Stnalley教授及英国科学家Kicto教授为此获得了1996年闹贝尔化学奖
碳是最早被发现和利用的元素之一,长期以来人们以为单质碳的同素异形体只有精钢石、石墨、和无定型碳三种,1985年C60的发现将人类领入认识碳的全新领域--富勒烯,美国科学家Curl和Stnalley教授及英国科学家Kicto教授为此获得了1996年闹贝尔化学奖查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com