
碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2•yCuCO3.
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2•CuCO3.某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50mol•L﹣1的Cu(NO3)2溶液、2.0mL 0.50mol•L﹣1的NaOH溶液和0.25mol•L﹣1的Na2CO3溶液按表Ⅰ所示体积混合.
实验2:将合适比例的混合物在表Ⅱ所示温度下反应.
实验记录如下:
| 编号 | V (Na2CO3)/mL | 沉淀情况 | 编号 | 反应温度/℃ | 沉淀情况 | |
| 1 | 2.8 | 多、蓝色 | 1 | 40 | 多、蓝色 | |
| 2 | 2.4 | 多、蓝色 | 2 | 60 | 少、浅绿色 | |
| 3 | 2.0 | 较多、绿色 | 3 | 75 | 较多、绿色 | |
| 4 | 1.6 | 较少、绿色 | 4 | 80 | 较多、绿色(少量褐色) |
表Ⅰ表Ⅱ
①实验室制取少许孔雀石,应该采用的条件是 n[Cu(NO3)2]:n(Na2CO3)=2:1,75℃ .
②80℃时,所制得的孔雀石有少量褐色物质的原因是 Cu(OH)2受热分解为CuO .
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:
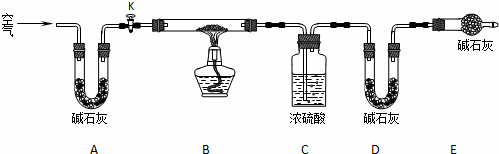
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中.
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量.
步骤3:加热装置B直至装置C中无气泡产生.
步骤4: 继续通一段时间空气至装置冷却 .
步骤5:称量相关装置的质量.
①装置A的作用是 除去空气中的CO2和H2O ;若无装置E,则实验测定的x/y的值将 偏小 (选填“偏大”、“偏小”或“无影响”).
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的 BC、BD、CD (写出所有组合的字母代号)一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式 5Cu(OH)2•2CuCO3 .
| 制备实验方案的设计.. | |
| 专题: | 实验设计题. |
| 分析: | (1)①根据表中碳酸钠的物质的量与硝酸铜的物质的量关系及最佳生成碱式碳酸铜温度完成; ②所制得的孔雀石有少量褐色物质是氧化铜,氢氧化铜分解生成了黑色的氧化铜; (2)步骤4反应完毕后,需要继续通空气,让装置冷却; ①根据实验目的和碱石灰的作用分析; ②根据化学方程式找出与x、y有关的物质质量. |
| 解答: | 解:(1)①由表中数据,0.25mol•L﹣1的碳酸钠溶液2mL时生成的孔雀石最多,杂质最少,此时n[Cu(NO3)2]:n(Na2CO3)=2:1;当温度在75℃,生成的孔雀石最多,杂质最少, 故答案为:n[Cu(NO3)2]:n(Na2CO3)=2:1、75℃; ②温度较高,氢氧化铜分解生成了氧化铜,所制得的孔雀石有少量褐色物质是氧化铜, 故答案为:Cu(OH)2受热分解为CuO; (2)步骤4反应完毕后,需要继续通空气,让装置冷却, 故答案为:继续通一段时间空气至装置冷却; ①装置A碱石灰是干燥剂,可吸收空气中的水分,同时还能吸收空气中的二氧化碳,防止对装置CD增重的数据造成影响,装置E的作用是防止空气中的二氧化碳和水蒸气进入D装置,D装置是吸收生成的二氧化碳的,C装置是吸收生成的水的,如果没有装置E,会使D装置质量增重偏大,即生成的二氧化碳质量偏大,则x/y的值会偏小 故答案为:除去空气中的CO2和H2O; 偏小; ②碱式碳酸铜分解的化学方程xCu(OH)2•yCuCO3 xCu(OH)2•yCuCO3 18x 44y 9g 8.8g
若测出反应后玻璃管中样品的质量以及装置C增重的质量,即已知方程式中氧化铜和水的质量关系,可求出 xCu(OH)2•yCuCO3 (x+y)×80 18x 56g 9g
同样若已知反应后玻璃管中样品的质量以及装置C增重的质量,即已知方程式中氧化铜和二氧化碳的质量关系,可求出出 xCu(OH)2•yCuCO3 (x+y)×80 44y 56g 8.8
故答案为:BC、BD、CD;5Cu(OH)2•2CuCO3. |
| 点评: | 本题考碱式碳酸铜样品组成,涉及了根据化学方程式计算分析物质组成,浓硫酸增重的质量是生成的水的质量,碱石灰增重的质量是生成的二氧化碳的质量. |


科目:高中化学 来源: 题型:
无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过图实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为( )
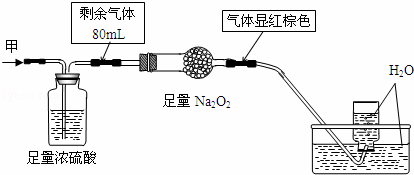
|
| A. | NH3、NO2、N2 | B. | NH3、NO、CO2 | C. | NH3、NO2、CO2 | D. | NO、CO2、N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列曲线图(纵坐标为沉淀的量,横坐标为加入物的量)与对应选项不正确的是( )
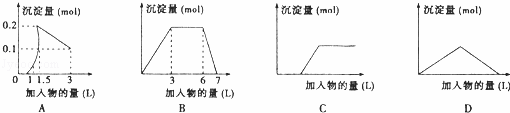
|
| A. | 向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合液中加入0.1 mol/L稀H2SO4溶液 |
|
| B. | 向含有0.1 mol/L AlCl3和0.3mol/L NH4Cl的1L混合液中加入0.1mol/L NaOH溶液 |
|
| C. | 向烧碱溶液中滴加明矾溶液 |
|
| D. | 向Ca(OH)2溶液中逐渐通入二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应N2(g)+3H2(g)⇌2NH3(g)+Q;Q>0,下列研究目的和示意图相符的是 ( )
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |
|
|
|
|
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
小明做实验时不小心沾了一些KMnO4,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4﹣+H2C2O4+H+→CO2↑+Mn2++□(未配平).关于此反应的叙述正确的是( )
|
| A. | 该反应的氧化剂是H2C2O4 | B. | 1molMnO4﹣在反应中失去5mol电子 |
|
| C. | 该反应右框内的产物是OH﹣ | D. | 配平该反应后,H+的计量数是6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或结论表述正确的是( )
|
| A. | 纸层析实验中若选择水做固定相,有机溶剂做流动相,则亲水性强的成分在流动相中分配的少一些,在毛细现象作用下,随流动相移动的速度快一些 |
|
| B. | 判断CuO和MnO2对H2O2分解的催化效率,可通过比较H2O2溶液析出气泡的快慢程度,或测定单位时间内产生氧气的体积 |
|
| C. | 食醋总酸含量测定实验中,实验结束时碱式滴定管尖嘴部位有气泡,则测定的醋酸含量偏高 |
|
| D. | 将硫酸亚铁和硫酸铵的混合溶液加热浓缩,冷却结晶后可析出摩尔盐粗产品,再用酒精洗去晶体表面的水分,加热烘干后称重,计算产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是
A.Fe2++SO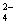 +Ba2++2OH-=BaSO4↓+Fe(OH)2↓
+Ba2++2OH-=BaSO4↓+Fe(OH)2↓
B.NH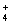 +Fe3++ 2SO
+Fe3++ 2SO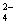 + 2Ba2+
+ 2Ba2+ + 4OH-=2BaSO4↓+ Fe(OH)3↓+ NH3·H2O
+ 4OH-=2BaSO4↓+ Fe(OH)3↓+ NH3·H2O
C.2Fe3++ 3SO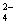 + 3Ba2++6OH-=3BaSO4↓+ 2Fe(OH)3↓
+ 3Ba2++6OH-=3BaSO4↓+ 2Fe(OH)3↓
D.3NH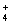 + Fe3++3SO
+ Fe3++3SO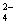 + 3Ba2++ 6OH-=3BaSO4↓+Fe(OH)3↓+3NH3·H2O
+ 3Ba2++ 6OH-=3BaSO4↓+Fe(OH)3↓+3NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:


已知:3NO3-+ 8Al + 5OH- + 2H2O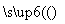 3NH3↑+ 8AlO2-
3NH3↑+ 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是
A.试样中肯定存在NH4+、Mg2+、SO42-和NO3-
B.试样中一定不含Al3+
C.试样中可能存在Na+、Cl-
D.该雾霾中可能存在NaNO3 、NH4Cl和MgSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com