
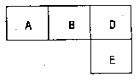
 有M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在表(周期表的一部分)占有相应的位置,它们的原子序数之和为37.试回答:
有M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在表(周期表的一部分)占有相应的位置,它们的原子序数之和为37.试回答:

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
 有M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻
有M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻查看答案和解析>>
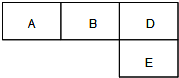
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2010年福建省莆田实验中学高考化学模拟最后一卷(解析版) 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2011年江苏省宿迁市宿城区剑桥国际学校高考化学四模试卷(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com