
| A. | 常温下,甲基橙呈红色的溶液中:Na+、NH4+、SO42-、CH3COO- | |
| B. | 滴入酚酞试液显红色的溶液:Na+、Ba2+、NO3-、Cl- | |
| C. | 由水电离出的c(H+)=1×10-13mol/L的溶液:NH4+、K+、CO32-、Cl- | |
| D. | 含有大量HCO3-的溶液:K+、Al3+、Cl-、Na+ |
分析 A.常温下,甲基橙呈红色的溶液呈酸性;
B.滴入酚酞试液显红色的溶液呈碱性;
C.由水电离出的c(H+)=1×10-13mol/L的溶液,为酸或碱溶液;
D.与HCO3-反应的离子不能大量共存.
解答 解:A.常温下,甲基橙呈红色的溶液呈酸性,酸性条件下CH3COO-不能大量共存,故A错误;
B.滴入酚酞试液显红色的溶液呈碱性,离子之间不发生任何反应,可大量共存,故B正确;
C.由水电离出的c(H+)=1×10-13mol/L的溶液,为酸或碱溶液,碱性条件下NH4+不能大量共存,酸性条件下CO32-不能大量共存,故C错误;
D.Al3+与HCO3-发生互促水解反应而不能大量共存,故D错误.
故选B.
点评 本题考查离子的共存,为高考高频考点,侧重复分解反应、氧化还原反应、络合反应的离子共存的考查,注意把握习题中的信息及常见离子之间的反应,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②⑤ | C. | ②④⑤ | D. | ②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
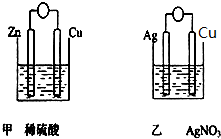
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液pH不断增大,最后为7 | B. | 阳极先析出Cl2,后析出O2 | ||
| C. | 阴极始终只析出H2 | D. | 电解最后阶段为电解水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
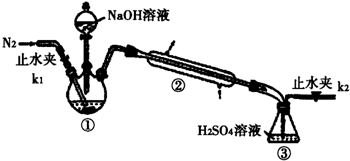
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com