
【题目】某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子。向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图像如图所示。

(1)A、B、C、D四点中沉淀成分相同的是(写代号)_______________
(2)由图像可推出原溶液中一定含有的离子有:____________________
(3)若要检验可能存在的离子应采取的方法是______________________
(4)原溶液中含有的Fe3+和Al3+的物质的量之比为______________
(5)由图像计算使用的NaOH溶液的物质的量浓度是________________
【答案】B、C点 H+、NH4+、Fe3+、Al3+、SO42- 利用焰色反应判断,焰色反应呈黄色,证明含有钠离子 1:1 1mol/L
【解析】
根据图象中最初没有沉淀可知,一定有H+;CD段,生成的沉淀又溶解了一部分,可知一定有Al3+,BC段,和氢氧化钠反应不产生沉淀,说明有NH4+,根据坐标可知氢氧化铝溶解用了1L的氢氧化钠,生成沉淀用了6L的氢氧化钠,所以形成氢氧化铝用了3L的氢氧化钠,还有3L的氢氧化钠一定是和Fe3+反应,所以一定含有Fe3+,则一定不含CO32-,即原溶液中一定含有的阳离子有H+、NH4+、Fe3+、Al3+;由于溶液呈电中性,则一定有SO42-;Na+可能存在;
(1)A、B、C、D四点中沉淀成分相同的是B、C点;
(2)原溶液中一定含有的离子有:H+、NH4+、Fe3+、Al3+、SO42-;
(3)钠离子可能存在,可利用焰色反应判断,焰色反应呈黄色,证明含有钠离子;
(4)根据坐标可知氢氧化铝溶解用了1L的氢氧化钠,生成沉淀用了6L的氢氧化钠,所以形成氢氧化铝用了3L的氢氧化钠,还有3L的氢氧化钠一定是和Fe3+反应,则原溶液中含有的Fe3+和Al3+的物质的量之比为1:1;
(5)根据坐标可知氢氧化铝溶解了1mol用了1L的氢氧化钠,则n(NaOH)=1mol,c(NaOH)=1mol/L。


科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)羟基的电子式_______
(2)某气态有机物相对于氢气的密度为 14,则其结构简式为_______。
(3)某有机物的结构简式如图所示,则其一氯代物共有_______种。
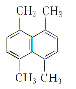
(4)新戊烷用系统命名法命名应为_______。
(5)分别将等物质的量的 C3H8、C4H8 完全燃烧,消耗氧气质量多的是_______(填分子式)。
(6)下列最简式中,只能代表一种有机物的有_______ (选填对应的序号)。
①CH3 ②CH2 ③CH2O ④CH4O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在容积为1L的密闭容器中充入![]() 和
和![]() 发生
发生![]() 测得
测得![]() 的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数
的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数![]() )下列说法正确的是 ( )
)下列说法正确的是 ( )
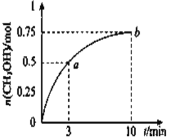
A. ![]()
B. 点b所对应的状态为化学平衡状态
C. ![]() 的生成速率,点a低于点b
的生成速率,点a低于点b
D. 欲增大平衡状态时![]() ,可保持其他条件不变,升高温度
,可保持其他条件不变,升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,有顺反异构体的是( )
A. 1,2﹣二氯乙烯ClCH=CHCl
B. 1,1﹣二氯乙烯 Cl2C=CH2
C. 丙烯 CH3﹣CH=CH2
D. 苯乙烯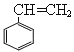
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知合金A由两种常见的金属组成。为测定其组成,某同学的实验流程如图所示:

请回答:
(1)合金A中的两种金属为_____(填化学式)。
(2)过程②中分离C和E的化学实验基本操作是________。
(3)溶液H中所含的阳离子有_____(用离子符号表示)。
(4)为测定合金的组成,若需要称量沉淀F的质量,则F需要洗涤,证明沉淀F洗涤干净的方法是_____________________。
(5)写出②③及由溶液H和氨水反应生成白色沉淀的离子方程式(没有离子方程式的写化学方程式):
过程②___________________;
______________________;
_______________________。
过程③_______________。
溶液H与氨水:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:

(1)若A、B、C的焰色反应均为黄色,C为厨房中的用品,D的过度排放会造成温室效应。
①A的化学式______________、B的俗名____________;
②反应II的离子方程式是__________________________________。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应II的离子方程式是_____________________________;
②反应Ⅲ的离子方程式是_____________________________;
③检验B中阳离子最好的方法是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是
A. 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键
B. 乳酸有一对对映异构体,因为其分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”解释
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数 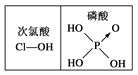
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的单质和常见的化合物在工、农业生产中用途广泛。
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
N2 | O2 | Ar | CO2 |
-196℃ | -183℃ | -186℃ | -78℃ |
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是______.
(2)雷雨时空气中的N2转化为NO,生成物NO是______色的气体,______(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应,写出NO2与水反应的化学方程式为__________________.
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气;
①制取氨气的化学方程式为__________________;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为______g;
(4)已知:4NH3+6NO![]() 5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能;
5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能; ![]()
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同);
①NH3与稀硫酸溶液反应的离子方程式为__________________;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:A(s)+3B(g)![]() 2C(g) ΔH<0,在体积为10L的密闭容器中发生反应的过程如图所示。下列说法正确的是( )
2C(g) ΔH<0,在体积为10L的密闭容器中发生反应的过程如图所示。下列说法正确的是( )
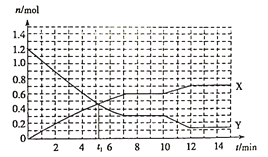
A. X曲线表示B的物质的量随时间变化的关系
B. 第t1 min时说明反应达到了平衡
C. 前4 min,用C表示反应速率为v(C)=0.1 mol·L-1·min-1
D. 第10 min时,可能采取了降温
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com