
【题目】Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。一种制取Cl2O的装置如图所示。
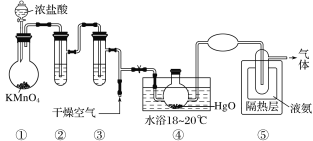
已知:Cl2O的熔点为-116℃,沸点为3.8℃;Cl2的沸点为-34.6℃;HgO+2Cl2=HgCl2+Cl2O。
下列说法中不正确的是( )
A.装置②③中盛装的试剂依次是饱和食盐水和浓硫酸
B.通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险
C.从装置⑤中逸出气体的主要成分是Cl2
D.装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列依据所给条件推出的结论不正确的是( )
选项 | 条件 | 结论 |
A | 在水溶液中或熔融状态下可以导电的化合物称为电解质 | CH3COOH水溶液中存在:CH3COOH |
B | 凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱 | H2O既是酸又是碱 |
C | Fe3Cl8可以改写为FeCl2·2FeC13 | Fe3I8可以改写为FeI·2FeI3 |
D | HCl在一定条件下能被MnO2氧化为Cl2 | HBr在一定条件下也能被MnO2氧化为Br2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,105℃时,1 L该混合烃与9 L O2混合,充分燃烧后恢复到原状况,所得气体体积仍为10 L。下列各组混合烃中不符合此条件的是 ( )
A.CH4、C2H4B.CH4、C3H6
C.C2H4、C3H4D.CH4、C3H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a mol H2和b mol C2H2在密闭容器中反应,当其达到平衡时,生成c mol C2H4,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量为
A. (![]() )mol B. (a+3b)mol
)mol B. (a+3b)mol
C. (![]() )mol D. (a+3b+2c)mol
)mol D. (a+3b+2c)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)是一种重要的化工原料。工业上采用以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3。Al2O3)为原料生产硼酸和轻质氧化镁,其工艺流程如下:
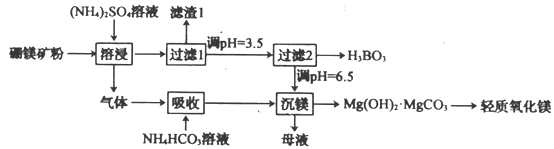
下列叙述错误的是
A.“溶浸”中产生的气体是氨气
B.“滤渣1”是SiO2
C.“过滤2”前,将溶液pH调节至3.5,目的是转化为硼酸沉淀
D.“沉镁”中得到的母液经加热后可返回“溶浸”工序循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】其它燃料电池负极(燃料)电极反应式的书写
(1)烃燃料电池
①酸性介质
CH4:1CH4—8 e—+2H2O= 1CO2+8H+
C2H6 :____________
C2H2 : ___________
②碱性介质
CH4:1CH4—8 e—+ 10OH—= 1 CO32—+ 7 H2O
C2H6:1 C2H6—14e— + 18OH—= 2CO32—+12H2O
C2H2:______________
(2)烃的含氧衍生物燃料电池
①酸性介质
CH3OH:1CH3OH—6e—+1H2O = 1CO2+6 H+
C2H5OH: ______________
CH3OCH3:_____________
②碱性介质
CH3OH: 1CH3OH—6e—+8OH —= 1CO32—+ 6 H2O
C2H5OH: ___________
CH3OCH3:___________
(3)熔融碳酸盐为电解质
负极(CH4):___________
正极(O2):______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z三种元素均为短周期元素,原子序数依次递增,Q、W为前30号元素。5种元素的部分特点:
元素 | 特点 |
X | 其气态氢化物呈三角锥形,水溶液显碱性 |
Y | 基态原子核外有三个能级,其中最外层电子数等于次外层电子数的3倍 |
Z | 元素原子的外围电子层排布式为nsn-1npn-1 |
Q | 被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
W | 原子M能级层为全充满状态且核外的未成对电子只有一个 |
(1)XF3分子中X的杂化类型为______,该分子的空间构型为_______.
(2)基态Q原子的电子排布式为_____________________,第一电离能:X______Y(填“>” “<”或“=”) .
(3)X、Y、Z电负性由大到小的顺序为____________(用元素符号表示).
(4)Na在Y2中燃烧产物的电子式为________________.
(5)Z和X形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于_______晶体.
(6)W元素与X元素形成某种化合物的晶胞结构如图所示(黑球代表W原子),若该晶体的密度为ρ g·cm-3,则该晶胞的体积是__________cm3.
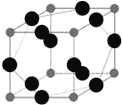
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单一盐溶液中离子浓度比较
(1)NH4Cl溶液中存在的水解平衡是________,使c(H+)___c(OH-)、c(Cl-)_____c(NH4+),盐类的水解是很微弱的,所以溶液中剩余未水解的NH4+的浓度_______水解产生的OH-的浓度。所以溶液中离子浓度大小关系是________。
(2)Na2CO3溶液中存在的水解平衡是__________、_______离子浓度大小关系是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com