
| 实验序号 | 金属质量 | 金属状态 | c(H2SO4)/mol•L-1 | V(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
分析 根据影响化学反应速率的因素分析:
固体颗粒的大小,在其他条件相同时,固体颗粒越小,反应物的表面积越大,化学反应速率越快;固体颗粒越大,固体反应物的表面积越小,化学反应速率降低;
反应物的浓度,在其他条件相同时,增大反应物的浓度,化学反应速率加快;减小反应物的浓度,反应速率降低;
反应物的温度,在其他条件相同时,升高反应物的温度,化学反应速率加快;降低反应物的温度,反应速率降低.
解答 解:(1)观察实验4和5,金属和稀硫酸的量相同,金属的状态不同,可知固体的表面积越大反应速率越快,能表明这一规律另一组实验从表中数据得出是1和2,
故答案为:固体反应物的表面积;固体表面积越大;1和2;
(2)仅表明反应物浓度对反应速率产生影响的实验,金属的状态就应该相同,2和5都是粉末,只有硫酸浓度不同,符合这一规律,
故答案为:2和5;
(3)实验6和7,8和9只有温度不同,其他相同,实验是探究温度对反应速率的影响,
故答案为:反应温度;7;9;
(4)可能是稀硫酸过量,等质量的金属完全反应,放出的热量相等,所以使反应前后溶液的温度变化值相近,
故答案为:可能是反应物硫酸过量,金属用量相同,放出的热量相同.
点评 本题考查影响化学反应速率的因素:固体的表面积、反应物的浓度、反应物的温度,注意这种以表格形式出现的题目,考查学生整理数据、分析数据的能力,此题难度适中.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
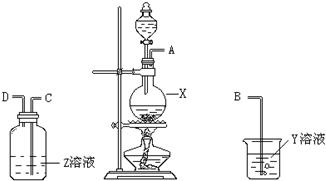 某化学课外兴趣小组为探究铜与浓硫酸反应产物的性质,拟用如图所示的装置进行实验.
某化学课外兴趣小组为探究铜与浓硫酸反应产物的性质,拟用如图所示的装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时,其他条件不变,升高温度平衡正向移动 | |
| B. | 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 | |
| C. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 | |
| D. | 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
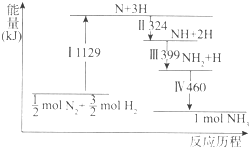
| A. | Ⅰ中破坏的均为极性键 | B. | Ⅱ、Ⅲ、Ⅳ均为放热过程 | ||
| C. | Ⅳ中NH2与H2生成NH3 | D. | N2(g)+3H2(g)?2NH3(g)是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 酸碱中和反应是放热反应 | |
| B. | 图1所示的反应为吸热反应 | |
| C. | 图2装置中铜片是负极,锌片表面有气泡出现 | |
| D. | 图2装置是将电能转变为化学能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清的石灰水与稀硝酸反应:OH-+H+═H2O | |
| B. | 氢氧化钡溶液与硫酸的反应:OH${\;}^{{-}^{\;}}$+H+═H2O | |
| C. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 醋酸溶液与碳酸钙反应:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com