
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新生活方式.分析 (1)①根据盖斯定律,由已知热化学方乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数并进行相应的加减,据此计算;
②根据氧化还原反应规律,CO与PdCl2溶液反应,PdCl2被还原成单质,则CO被氧化成CO2,根据质量守恒定律,有水参与反应同时生成氯化氢,据此写出反应的化学方程式即可;
(2)①根据C3H8和O2构成丙烷燃料电池的总反应:C3H8+5O2+6OH-=3CO32-+7H2O,正极发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-,而负极电极反应式=总反应方程式-正极的电极反应式来解答;
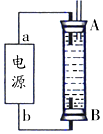
②A、B端析出氢气可驱赶原溶液中溶解的少量氧气;
B、电解液选用NaCl溶液不影响实验,因为阳极是铁失电子生成亚铁离子,溶液中的阴离子不放电;
C、阳极应该用铁电极,阴极用惰性电极亦可;
D、B电极反应是阴极氢离子放电生成氢气.
解答 解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ/mol ①
C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ/mol ②
由①-②×3,得到热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氧化还原反应规律,CO与PdCl2溶液反应,PdCl2被还原成单质,则CO被氧化成CO2,根据质量守恒定律,有水参与反应同时生成氯化氢,反应的化学方程式为:PdCl2+CO+H2O=Pd+CO2+2HCl,
故答案为:PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)①C3H8和O2构成丙烷燃料电池的总反应:C3H8+5O2+6OH-=3CO32-+7H2O,正极发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-,负极发生氧化反应,电极反应式为:C3H8 +26OH--20e-=3CO32-+17H2O,
故答案为:C3H8 +26OH--20e-=3CO32-+17H2O;
②A、因为生成的氢气将装置中原有氧气溢出,所以氢气从B端阴极析出,A电极则是铁做阳极失去电子生成亚铁离子,电源中的a与A相连,则a为正极,b与B相连,则b为负极,故A正确;
B、电解池中阳极是铁失去电子发生氧化反应生成亚铁离子,阴极是溶液中的氢离子得电子发生还原反应,所以电解质溶液中的阴离子不会在阳极失电子,所以选用NaCl溶液不影响实验,故B正确;
C、阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,故C错误;
D、阴极氢离子放电,其电极反应为2H++2e-=H2↑,故D正确;
故答案为:ABD.
点评 本题考查热化学方程式、电极反应的书写,做题时注意把握影响平衡移动的因素、原电池、电解池原理和电极书写,题目难度中等.


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.氮原子的质量就是氮的相对原子质量 B.氢氧化钠的摩尔质量是40g
C .1molH2SO4中含1molH2 D.1molH2O的质量是18g
.1molH2SO4中含1molH2 D.1molH2O的质量是18g
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)某容器中发生了一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种粒子,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.
(1)某容器中发生了一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种粒子,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN | B. | 氨水 | C. | 盐酸 | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,由分子式为C4H8的烯烃进行醛化反应,得到醛的同分异构体的数目为( )
,由分子式为C4H8的烯烃进行醛化反应,得到醛的同分异构体的数目为( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
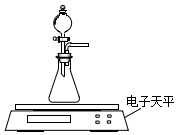 碳酸钙、盐酸是中学化学实验中的常用试剂.
碳酸钙、盐酸是中学化学实验中的常用试剂.| 物理量 实验序号 | V(0.1mol•L-1 HCl)/mL | m(颗粒状CaCO3)/g | m(粉末状CaCO3)/g | V(蒸馏水)/mL | ⑤ | ⑥ |
| 实验1 | a | b | 0 | c | d | |
| 实验2 | ① | 0 | ③ | c | d | |
| 实验3 | c | ② | 0 | ④ | d |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com