
| A. | 酒精及其他易燃物小面积失火,应该迅速使用湿抹布扑盖;钠、钾等失火应用泡沫灭火器扑灭 | |
| B. | 用排水法收集气体时,先撤酒精灯后移出导管 | |
| C. | 少量氢氧化钠溶液沾在皮肤上,立即用水冲洗,再涂碳酸氢钠溶液 | |
| D. | 有大量的氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻向高处跑 |
分析 A.钠、钾的燃烧产物能够与二氧化碳反应生成氧气;
B.先撤酒精灯后移出导管,容易发生倒吸现象;
C.用水冲洗后应该涂上稀的硼酸溶液;
D.氯气有毒,能够与碱溶液反映,且密度大于空气.
解答 解:A.酒精及其他易燃物小面积失火,可迅速使用湿抹布扑盖,但是钠、钾等失火不能用泡沫灭火器扑灭,因为钠、钾及其燃烧产物能够与二氧化碳反应,可用沙子灭火,故A错误;
B.用排水法收集气体时,应该先撤出导管再熄灭酒精灯,避免发生倒吸现象,故B错误;
C.氢氧化钠具有腐蚀性,少量氢氧化钠溶液沾在皮肤上,立即用水冲洗,再涂稀的硼酸溶液,故C错误;
D.氯气能够与碱溶液反应,密度大于空气,所以大量的氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻向高处跑,故D正确;
故选D.
点评 本题考查了化学安全事故及处理方法,题目难度不大,明确常见化学药品的性质为解答关键,注意掌握化学实验氨气事故及处理方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
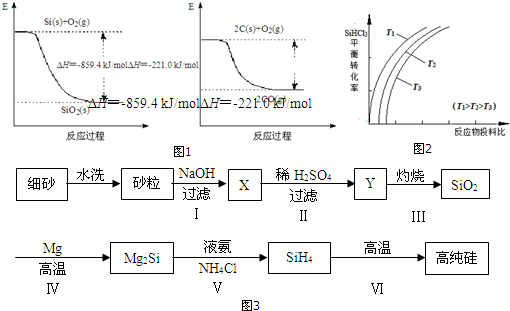
 ;
; ;仅由极性键形成的非极性分子的结构式为
;仅由极性键形成的非极性分子的结构式为 ,该分子中心原子的杂化轨道类型是sp3杂化;简单氢化物的沸点最高的是H2O.
,该分子中心原子的杂化轨道类型是sp3杂化;简单氢化物的沸点最高的是H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
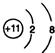
 CH3CH2OH反应类型是加成反应;B+C→D的化学方程式为:CH3COOH+C2H5OH
CH3CH2OH反应类型是加成反应;B+C→D的化学方程式为:CH3COOH+C2H5OH  CH3COOC2H5+H2O.反应类型是酯化反应或取代反应;
CH3COOC2H5+H2O.反应类型是酯化反应或取代反应;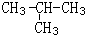 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
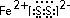 .
.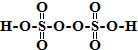
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
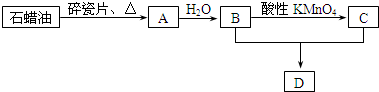
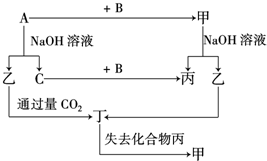 由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图所示的转换关系,已知C为密度最小的气体,甲是电解质.
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图所示的转换关系,已知C为密度最小的气体,甲是电解质. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1•min-1 | B. | 0.6mol•L-1•min-1 | ||
| C. | 1.8mol•L-1•min-1 | D. | 3.6mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

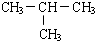 ,它的一氯取代产物有2种.
,它的一氯取代产物有2种.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com