
某烃的分子式为C10H14,它不能使溴水褪色,但能使酸性KMnO4溶液褪色,分子结构中只含有一个烷基,符合条件的烃有( )
A.2种 B.3种 C.4种 D.5种
科目:高中化学 来源: 题型:
实验:①0.1 mol·L-1AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加0.1 mol·L-1KI溶液,出现浑浊;
③向沉淀c中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
下列分析不正确的是( )
A.浊液a中存在沉淀溶解平衡:AgCl(s)??Ag+(aq)+Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl转化为AgI
D.实验可以证明AgI比AgCl更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
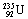 是重要的核工业原料,在自然界的存在很少。
是重要的核工业原料,在自然界的存在很少。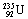 的浓缩一直为国际社会关注。下列有关
的浓缩一直为国际社会关注。下列有关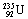 说法正确的是 ( )
说法正确的是 ( )
A.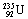 原子核中含有92个中子 B.
原子核中含有92个中子 B.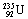 原子核外有143个电子
原子核外有143个电子
C.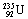 与
与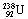 互为同位素 D.
互为同位素 D.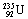 与
与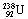 互为同素异形体
互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化钠(Na3N)是科学家制备的一种重要化合物。它与水作用可生成NH3 和一种强碱。回答下列问题:
(1)氮化钠的电子式是 ,该化合物是 化合物(选填“离子”、“共价”)。
(2)氮化钠与水反应的化学方程式是 ,该反应属于 反应。
(3)氮化钠与盐酸反应生成 种盐,其中 (填盐的化学式)既含离子键又含有共价键。
(4)氮化钠中两种微粒的半径大小比较:r(Na+) r(N3-)(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物的结构可用“键线式”表示,如:CH3CHCHCH3可简写为 。有机物X的键线式为
。有机物X的键线式为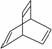 ,下列说法不正确的是 ( )
,下列说法不正确的是 ( )
A.X的化学式为C8H8
B.有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为
C.X能使酸性高锰酸钾溶液褪色
D.X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
异丙苯[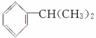 ]是一种重要的化工原料,下列关于异丙苯的说法不正确的是 ( )
]是一种重要的化工原料,下列关于异丙苯的说法不正确的是 ( )
A.异丙苯是苯的同系物
B.可用酸性高锰酸钾溶液区别苯与异丙苯
C.在光照的条件下,异丙苯与Cl2发生取代反应生成的氯代物有三种
D.在一定条件下能与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:R—CH===CH2+HX—→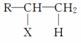 。
。
A、B、C、D、E有如下转化关系:
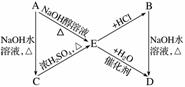
其中A、B是化学式均为C3H7Cl的两种同分异构体。根据图中各物质的转化关系,填写下列空白:
(1)A、B、C、D、E的结构简式:A________、B________、C________、D________、E________。
(2)完成下列反应的化学方程式:
①A—→E_____________________________________________________________________;
②B—→D_____________________________________________________________________;
③C—→E____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下面是几种有机化合物的转换关系:
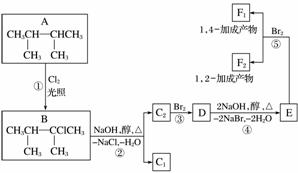
请回答下列问题:
(1)根据系统命名法,化合物A的名称是__________。
(2)上述框图中,①是__________反应,③是__________反应。(填反应类型)
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:________________________________________________________________________
________________________________________________________________________。
(4)C2的结构简式是__________________________________________________,
F1的结构简式是_______________________________________________________,
F1和F2互为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________。
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
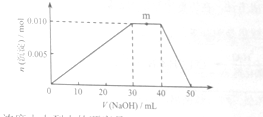
①R离子浓度由大到小的顺序是:__________。
②写出m点反应的而梨子方程式_________________。
③若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为__________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com