
【题目】分枝酸可用于生化研究,其结构简式为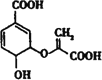 ,下列关于分枝酸的说法不正确的是
,下列关于分枝酸的说法不正确的是
A.分子中含有3种含氧官能团
B.1mol分枝酸最多可与2molNaOH发生中和反应
C.在一定条件下可与乙醇、乙酸反应,但反应类型不相同
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液退色,但退色原理不同
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家分获,以表彰他们在分子机器设计与合成领域方面的成就,其中一种光驱分子马达结构如右图所示。有关该分子的说法不正确的是
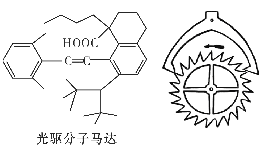
A. 光驱分子马达的分子式是C34H46O2,属于烃的含氧衍生物
B. 分子机器设计与合成的研究成果为未来新材料的研发开启了广阔前景
C. 三位科学家通过研究质子和中子重新合成了新的元素
D. 光驱分子马达能与NaHCO3和酸性KMnO4溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物X的结构简式如图所示,下列有关叙述不正确的是( )

A.X的化学式为C10H10O6
B.X在一定条件下能与FeCl3溶液发生显色反应
C.1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、4 mol、1 mol
D.X在一定条件下能发生消去反应和酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应容器中充入1molA气体和n molB气体,在一定条件下发生反应:A(气)+nB(气)![]() mC(气),达平衡时,测得A的转化率为50%,在相同温度和相同压强下,平衡时混合气体的体积是反应前的
mC(气),达平衡时,测得A的转化率为50%,在相同温度和相同压强下,平衡时混合气体的体积是反应前的 ![]() ,则n和m的数值可能是( )
,则n和m的数值可能是( )
A. n=1 m=1 B. n=2 m=2
C. n=3 m=3 D. n=2 m=3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+2B2(g)![]() 2AB3(g) ΔH<0,相关数据如下表所示:
2AB3(g) ΔH<0,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1mol A2、2molB2 | 2molAB3 | 2mol AB3 |
反应物的转化率 | a甲 | a乙 | a丙 |
反应的平衡常数K= | K甲 | K乙 | K丙 |
平衡时AB3的浓度/mol·L-1 | c甲 | c乙 | c丙 |
平衡时AB3的反应速率/mol·L-1·min-1 | v甲 | v乙 | v丙 |
下列说法正确的是( )
A.v甲=v丙B.c乙<c丙C.a甲 +a乙<1D.K乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物物理性质描述错误的是
A.甲醛是一种无色,有强烈刺激性气味的气体,易溶于水,![]() 的甲醛水溶液叫做福尔马林
的甲醛水溶液叫做福尔马林
B.苯酚又名石炭酸、常温下为无色液体,当温度高于![]() 时,能跟水以任意比例互溶,其溶液沾到皮肤上用酒精洗涤
时,能跟水以任意比例互溶,其溶液沾到皮肤上用酒精洗涤
C.甲醇是无色有酒精气味易挥发的液体,有毒,误饮![]() 毫升能双目失明,大量饮用会导致死亡
毫升能双目失明,大量饮用会导致死亡
D.甲酸,无色而有刺激气味的液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=____,C=____,E=_____.
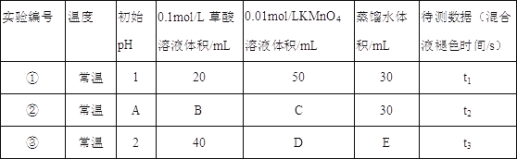
(2)该反应的离子方程式______________________________________.
(3)若t1<t2,则根据实验①和②得到的结论是_____________________________.
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:①__________________;②__________________________.
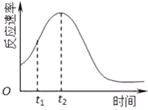
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O42H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:______________________________;实验中所需的定量仪器有__________________(填仪器名称).该KMnO4溶液的物质的量浓度为____mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于短周期的四种主族元素A、B、C、D,原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。E是自然界中含量最高的金属。根据你的推断完成下列问题:
(1)E元素在周期表中的位置为_______。
(2)写出由上述元素形成的具有漂白作用的三种物质的化学式_______。
(3)用电子式表示C与D形成化合物的过程_______。
(4)写出E的最高价氧化物与强碱反应的离子方程式________。
(5)B、C两元素形成的原子个数比为1:1的化合物中的化学键为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com