
| A. | 3.7 g的2H35Cl含质子数为1.9NA | |
| B. | 16 g O3和O2混合物中氧原子数为NA | |
| C. | 100 mL 1 mol•L-1AlCl3溶液中含的阳离子数等于0.1NA | |
| D. | 标准状况下,33.6 L氯气与28 g铁充分反应,转移的电子数为3NA |
分析 A、求出2H35Cl的物质的量,然后根据2H35Cl中含18个质子来分析;
B、氧气和臭氧均由氧原子构成;
C、铝离子水解导致阳离子个数增多;
D、标况下33.6L氯气的物质的量为1.5mol,和28g铁即0.5mol铁反应时,氯气过量,根据铁反应后变为+3价来分析.
解答 解:A、3.7g2H35Cl的物质的量为0.1mol,而2H35Cl中含18个质子,故0.1mol中含1.8NA个质子,故A错误;
B、氧气和臭氧均由氧原子构成,故16g混合物中含有的氧原子的物质的量为1mol,个数为NA个,故B正确;
C、铝离子水解导致阳离子个数增多,故此溶液中阳离子的个数多于0.1NA个,故C错误;
D、标况下33.6L氯气的物质的量为1.5mol,和28g铁即0.5mol铁反应时,氯气过量,而铁完全反应,由于铁反应后变为+3价,故0.5mol铁转移1.5NA个电子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 5.6 g Fe与足量盐酸反应,反应中转移的电子数为0.3NA | |
| B. | 0.1 mol FeCl3完全水解转化为氢氧化铁胶体,生成0.1NA个胶粒 | |
| C. | 常温下,28 g的N2和CO混合气体含有的原子数为2NA | |
| D. | 1mol Na2O2和足量CO2充分反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碳酸钠溶液吸收少量二氧化硫气体:2CO32-+SO2+H2O═2HCO3ˉ+SO32- | |
| B. | 金属铝溶于盐酸中 Al+2H+═Al3++H2↑ | |
| C. | 硫化钠溶于水 S2-+H2O═H2S↑+2OH- | |
| D. | 碳酸镁溶于硝酸中 CO32ˉ+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 由C与水反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
由C与水反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 向滤液a中加入适量溶液,可以得到白色沉淀 | |
| B. | 滤液b中加入氨水的目的是使沉淀,滤渣c为红褐色 | |
| C. | 要将Li从溶液中析出,可在滤液c中加入足量溶液,加热浓缩,冷却结晶 | |
| D. | 图中的氨水可以用适量NaOH溶液代替. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 是一种具有较好耐热性、耐水性和高频电绝缘性的高分子化合物(树脂),它是由三种单体在一定条件下缩聚(同时还生成水)而成的.这三种单体分别是(写结构简式)C6H5NH2、HCHO和
是一种具有较好耐热性、耐水性和高频电绝缘性的高分子化合物(树脂),它是由三种单体在一定条件下缩聚(同时还生成水)而成的.这三种单体分别是(写结构简式)C6H5NH2、HCHO和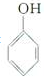 .它们的物质的量之比(按以上回答单体的顺序写)为1:2:1.
.它们的物质的量之比(按以上回答单体的顺序写)为1:2:1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com