
| A. | 0.1mol•L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1mol•L-1NaOH溶液中通入SO2气体至pH=7:c(Na+)=c(HSO3-)+2 c(SO32-)+c(H2SO3) | |
| C. | 等物质的量浓度的CH3COOH溶液与NaOH溶液等体积混合后所得pH=9的溶液:c(OH-)-c(CH3COOH)=c(H+)=l×10-9mol•L-1 | |
| D. | 20 mL0.1mol•L-1CH3COONa溶液与10 mL 0.1mol•L-1HCl溶液混合得到的溶液:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) |
分析 A、碳酸氢钠溶液呈碱性;
B、0.1mol•L-1NaOH溶液中通入SO2气体至pH=7,所以得溶液是亚硫酸钠和亚硫酸氢钠的混合溶液,根据电荷守恒分析解答;
C、等物质的量浓度的CH3COOH溶液与NaOH溶液等体积混合后所得醋酸钠溶液,根据质子守恒分析解答;
D、20 mL0.1mol•L-1CH3COONa溶液与10 mL 0.1mol•L-1HCl溶液混合得到的溶液得到物质的量浓度相等的氯化钠、醋酸钠和醋酸,根据电荷和物料守恒分析解答.
解答 解:A、碳酸氢钠的水解程度大于碳酸氢钠的电离程度,所以离子浓度大小:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故A错误;
B、0.1mol•L-1NaOH溶液中通入SO2气体至pH=7,所以得溶液是亚硫酸钠和亚硫酸氢钠的混合溶液,根据电荷守恒c(Na+)+c(H+)=c(HSO3-)+2 c(SO32-)+c(OH-),而溶液pH=7,说明c(H+)=c(OH-),所以c(Na+)=c(HSO3-)+2 c(SO32-),故B错误;
C、等物质的量浓度的CH3COOH溶液与NaOH溶液等体积混合后所得醋酸钠溶液,根据质子守恒得:c(H+)+c(CH3COOH)=c(OH-),所以c(OH-)-c(CH3COOH)=c(H+)=l×10-9mol•L-1,故C正确;
D、物质的量浓度相等的氯化钠、醋酸钠和醋酸,溶液中根据电荷守恒可知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-)①,而c(Na+)=2c(Cl-)②,②代入①得:c(Na+)+2c(H+)=2c(CH3COO-)+2c(OH-)③,根据物料守恒:c(Na+)=c(CH3COO-)+c(CH3COOH)④,将④代入③得:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),故D正确;
故选CD.
点评 本题考查离子浓度大小的比较,涉及弱电解质的电离和盐类的水解等问题,综合考查学生的化学知识应用能力和分析能力,题目难度中等.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y与Z位于同一周期 | B. | 单质氧化性:Y<W | ||
| C. | W的氢化物具强还原性 | D. | lmol C中含有离子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
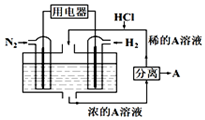 有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示,下列有关说法正确的是( )
有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示,下列有关说法正确的是( )| A. | 通入N2的一极为负极 | |
| B. | 通入H2的电极反应为:H2+2e-=2H+ | |
| C. | 物质A是NH4Cl | |
| D. | 反应过程中左边区域溶液pH逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
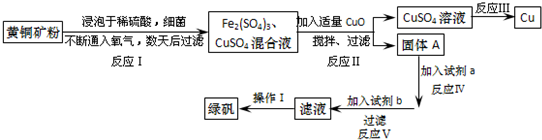
| Fe2+ | Cu2+ | Fe3+ | |
| 开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
| 完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 0 | 2 | 4 | 7 | 9 |
| n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
| A. | 反应前2 min的平均速率v(C)=0.004 mol/(L•min) | |
| B. | 其他条件不变,降低温度,反应达到新平衡前v (逆)>v (正) | |
| C. | 其他条件不变,起始时向容器中充入0.64mol A和0.64mol B,平衡时n(C)<0.48mol | |
| D. | 其他条件不变,向平衡体系中再充入0.32mol A,再次平衡时,B的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①中出现蓝色沉淀 | |
| B. | ③中现象是Cu(OH)2+2OH-?Cu(OH)42-正向移动的结果 | |
| C. | ④中现象证明葡萄糖具有还原性 | |
| D. | 对比②和④可知Cu(OH)2氧化性强于Cu(OH)42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com