
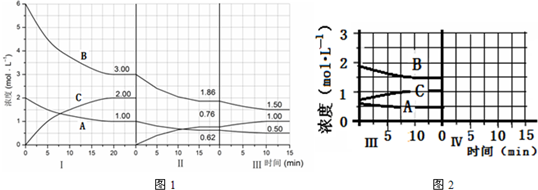
| 3mol/L |
| 6mol/L |
| 3mol/L-1.86mol/L |
| 3mol/L |
| 1.86mol/L-1.5mol/L |
| 1.86mol/L |
 ��
�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.24 mol |
| B��0.21 mol |
| C��0.25 mol |
| D��0.14 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
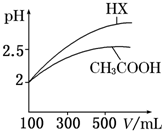
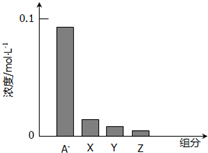 �����£�0.2mol/L��һԪ��HA���Ũ�ȵ�NaOH��Һ�������Ϻ�������Һ�в�������ּ�Ũ����ͼ��ʾ������˵����ȷ���ǣ�������
�����£�0.2mol/L��һԪ��HA���Ũ�ȵ�NaOH��Һ�������Ϻ�������Һ�в�������ּ�Ũ����ͼ��ʾ������˵����ȷ���ǣ�������| A��HAΪǿ�� |
| B���û��ҺpH=7 |
| C��ͼ��X��ʾHA��Y��ʾOH-��Z��ʾH+ |
| D���û����Һ�У�c��A-��+c��Y��=c��Na+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

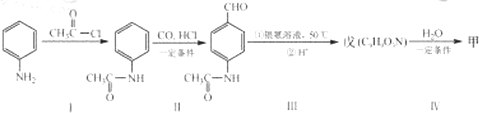
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��ѧʽ | CH3COOH | H2CO3 | HClO | |
| ����ƽ�ⳣ�� | Ka=1.8��10-5 | Ka1=4.3��10-7 | Ka2=5.6��10-11 | Ka=3.0��10-8 |
 �ش��������⣺
�ش��������⣺| c(H+) |
| c(CH3COOH) |
| c(OH-) |
| c(H+) |
| c(H+)?c(CH3COO-) |
| c(CH3COOH) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
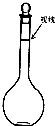 ʵ����Ҫ����480mL0.2mol/L NaOH��Һ����ش��������⣺
ʵ����Ҫ����480mL0.2mol/L NaOH��Һ����ش��������⣺�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com