
【题目】某同学用已知浓度的盐酸来测定某氢氧化钠样品的纯度(杂志不参与反应),试根据实验回答下列问题:
(1)准确称量5.0 g含有少量易溶杂质的样品,配成1L待测溶液。称量时,样品可放在________(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.100 0 mol·L-1的盐酸来滴定待测溶液,可选用________作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中氢氧化钠溶液放在锥形瓶中,则盐酸应该放在_______(填“甲”或“乙”)中。该同学选用酚酞做指示剂,如何判断达到滴定终点:_______________________________。

(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是______________ mol·L-1,烧碱样品的纯度是_______________。
滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 10.50 |
第二次 | 10.00 | 4.10 | 14.00 |
第三次 | 10.00 | 2.50 | 14.00 |
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
①观察酸式滴定管液面时,开始平视,滴定终点俯视,则滴定结果______________。
②滴定前酸式滴定管尖嘴处有气泡,滴定后气泡消失,则滴定结果______________。
③洗涤后锥形瓶未干燥,则滴定结果______________。
【答案】A AC 甲 当滴入最后一滴标准盐酸溶液时,溶液恰好由红色变为无色,且半分钟内不恢复,即达滴定终点 0.1000 80% 偏低 偏高 无影响
【解析】
(1)易潮解的药品,必须放在玻璃器皿(如:小烧杯、表面皿)里称量;
(2)强酸与强碱中和滴定时,可用酚酞或甲基橙做指示剂,石蕊变色范围宽且现象不明显,故一般不用石蕊作指示剂;
(3)滴定过程中氢氧化钠溶液放在锥形瓶中,盐酸应该放在酸式滴定管中;选用酚酞做指示剂,酚酞遇碱变红,当滴定终点时溶液变为无色;
(4)先由表格中的数据计算滴定10.00mL待测氢氧化钠溶液所消耗盐酸的平均体积,再计算氢氧化钠溶液的浓度,再计算1L待测溶液中氢氧化钠的物质的量,进而计算氢氧化钠的质量,最后计算烧碱样品的纯度;
(5)结合氢氧化钠溶液的计算公式![]() ,以及c(HCl)=0.1000mol/L,V(NaOH)=10.00ml,二者皆为定值,判断不当操作对于V(HCl)的影响,进而判断误差。
,以及c(HCl)=0.1000mol/L,V(NaOH)=10.00ml,二者皆为定值,判断不当操作对于V(HCl)的影响,进而判断误差。
(1)易潮解的药品,必须放在玻璃器皿(如:小烧杯、表面皿)里称量,防止玷污托盘,因氢氧化钠易潮解,所以应放在小烧杯中称量;
故答案为:A;
(2)强酸与强碱中和滴定时,可用酚酞或甲基橙做指示剂,石蕊变色范围宽且现象不明显,故一般不用石蕊作指示剂;
故答案为:AC;
(3)滴定过程中氢氧化钠溶液放在锥形瓶中,则盐酸应该放在酸式滴定管中,甲图为酸式滴定管;该同学选用酚酞做指示剂时,当滴入最后一滴标准盐酸溶液时,溶液恰好由红色变为无色,且半分钟内不恢复,即达滴定终点;
故答案为:甲;当滴入最后一滴标准盐酸溶液时,溶液恰好由红色变为无色,且半分钟内不恢复,即达滴定终点;
(4)由表格中的数据可知滴定10.00mL待测氢氧化钠溶液,第一次消耗标准盐酸的体积为(10.5-0.40)mL=10.1mL,第二次消耗标准盐酸的体积为(14.0-4.10)mL=9.90mL,第三次消耗标准盐酸的体积为(14.0-2.50)mL=11.5mL,第三次体积偏差较大,应该舍弃,则消耗盐酸的平均体积为![]() ,则
,则![]() ;则1L待测溶液中氢氧化钠的物质的量为0.1mol,则氢氧化钠的质量=0.1mol×40g/mol=4.0g,则烧碱样品的纯度是
;则1L待测溶液中氢氧化钠的物质的量为0.1mol,则氢氧化钠的质量=0.1mol×40g/mol=4.0g,则烧碱样品的纯度是![]() ;
;
故答案为:0.1000;80%;
(5)![]() ,其中c(HCl)=0.1000mol/L,V(NaOH)=10.00ml,二者皆为定值,
,其中c(HCl)=0.1000mol/L,V(NaOH)=10.00ml,二者皆为定值,
①观察酸式滴定管液面时,开始平视,滴定终点俯视,导致测得的盐酸体积偏小,则测得的氢氧化钠的浓度偏小,则最终导致氢氧化钠样品的纯度偏低;
故答案为:偏低;
②滴定前酸式滴定管尖嘴处有气泡,滴定后气泡消失,导致测得的盐酸体积偏大,则测得的氢氧化钠的浓度偏大,则最终导致氢氧化钠样品的纯度偏高;
故答案为:偏高;
③洗涤后锥形瓶未干燥,不影响锥形瓶中氢氧化钠的物质的量,因此不影响消耗盐酸的体积,则对滴定结果无影响;
故答案为:无影响。


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。
①仪器m的名称为___,装置F中试剂的作用是___。
②装置连接顺序:A→___→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是___。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和___。
(2)①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式___。
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH 溶液,该方案___(填“可行”或“不可行”),原因是___。
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:

①W溶液可以是___(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中气体X的体积分数为____(用含V、m的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Zn(s)+![]() O2(g)=ZnO(s) ΔH=-348.3kJ·mol-1;②2Ag(s)+
O2(g)=ZnO(s) ΔH=-348.3kJ·mol-1;②2Ag(s)+![]() O2(g)=Ag2O(s) ΔH=-31.0kJ·mol-1则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为( )
O2(g)=Ag2O(s) ΔH=-31.0kJ·mol-1则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为( )
A.Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s) ΔH=+317.3kJ·mol-1
B.Zn+Ag2O=ZnO+2Ag ΔH=+317.3kJ·mol-1
C.Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s) ΔH=-379.3kJ·mol-1
D.2Zn(s)+2Ag2O(s)=2ZnO(s)+4Ag(s) ΔH=-634.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用于日常生活用水和工业废水的净化处理。某工厂欲以工业废料(金属铁、铝及其氧化物)为原料、采用如下流程来制取PAFC:
![]()
下列判断无法确定的是
A.PAFC因水解而能净水B.往甲溶液中滴入KSCN溶液后呈血红色
C.试剂X具有氧化性D.乙溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是
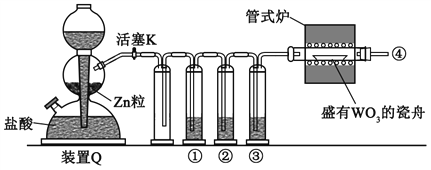
A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备绿矾(FeSO4·7H2O)和聚铁(碱式硫酸铁的聚合物),其过程如下:

(1)若用浓硫酸配制过程①所需的250mL3.0mol·L-1的稀硫酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要_____。
(2)过程②用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有_____(填仪器名称),该过程产生的尾气会对大气造成污染,可选用下列试剂中的_____吸收。
a.浓硫酸 b.蒸馏水 c.NaOH溶液 d.浓硝酸
(3)过程③中,需要加入的物质名称是____,检验溶液X中金属阳离子是否完全转化的试剂为_____(填试剂名称)。
(4)过程④的操作是将溶液______、_____、过滤、洗涤,即得到FeSO4·7H2O晶体。过程⑥中,将溶液Z加热到70~80℃,目的是__。
(5)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取样品2.700g;②将样品溶于足量盐酸后,加入足量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495g。若该聚铁主要成分为[Fe(OH)SO4]n,则该聚铁中铁元素的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某柔性屏手机的柔性电池以碳纳米管作电极材料,以吸收ZnSO4溶液的有机高聚物作固态电解质,其电池总反应为MnO2+![]() Zn+(1+
Zn+(1+![]() )H2O+
)H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4[Zn(OH)2]3·xH2O.其电池结构如图1所示,图2是有机高聚物的结构片段。下列说法中,不正确的是( )
ZnSO4[Zn(OH)2]3·xH2O.其电池结构如图1所示,图2是有机高聚物的结构片段。下列说法中,不正确的是( )

A.碳纳米管具有导电性,可用作电极材料
B.放电时,Zn2+移向MnO2膜
C.充电时,电池的阳极反应为MnOOH+e- =MnO2 + OH-
D.有机高聚物的单体![]() 中含有碳碳双键
中含有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1mol PCl5通入一个容积固定不变的密闭容器中,发生反应:PCl5(g) ![]() PCl3(g) + Cl2(g),反应达到平衡时,测得PCl5为0.4mol,此时再向容器中通入1mol PCl5,同样温度下再达到平衡时,测得PCl5为amol,下列判断正确的是
PCl3(g) + Cl2(g),反应达到平衡时,测得PCl5为0.4mol,此时再向容器中通入1mol PCl5,同样温度下再达到平衡时,测得PCl5为amol,下列判断正确的是
A. Cl2的体积分数增大 B. PCl5的分解率增大
C. a = 0.8 D. a > 0.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知同温同压下,下列反应的焓变和平衡常数分别表示如下,有关说法正确的是( )
(1)2SO2(g)+O2(g) ![]() 2SO3(g) △Hl=-197 kJ/mol K1=a
2SO3(g) △Hl=-197 kJ/mol K1=a
(2)2NO(g)+O2(g) ![]() 2NO2(g) △H2=-144 kJ/mol K2=b
2NO2(g) △H2=-144 kJ/mol K2=b
(3)NO2(g)+SO2(g) ![]() SO3(g)+NO(g) △H3=m kJ/mol K3=c
SO3(g)+NO(g) △H3=m kJ/mol K3=c
A. m=26.5 c2= a/b B. m--26.5 2c=a-b C. m=-170.5 2c=a-b D. m=53 c2=a/b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com