
【题目】化学反应中的物质变化和能量变化与化学键密切相关。依据所学知识回答下列问题:
(1)将装有二氧化氮和四氧化二氮混合气体的烧瓶分别侵入冷水和热水中,观察到的现象是______________________,由此得出的结论是_______________________________________。
(2)某同学根据原电池原理。将离子反应Cu+2Fe3+=Cu2++2Fe2+设计成原电池,在该原电池中,以FeCl3 为电解质溶液,以石墨为正极材料,负极材料应选用_______________,负极上发生________反应(填写“氧化“或“还原”)。当反应进行一段时间,测得负极电极质量减轻了6.4g,原电池的电路中转移电子的物质的量是____________________________。
(3)从能量角度看,断裂化学键吸收能量,形成化学键释放能量。
已知:断裂1molH-H键吸收的能量为436kJ,断裂气态ImolI-I键吸收的能量为151kJ,形成lmolH-I键放出的能量为299kJ。
则由氢气和碘蒸气反应生成1molHI需要________(填“放出“或“吸收”)_______kJ的热量
【答案】 侵入冷水的烧瓶里气体颜色变浅,侵入热水的烧瓶里气体颜色变深 当条件改变时,原来的化学平衡将被破坏,并在新的条件下建立起新的化学平衡,即化学平衡的移动 Cu 氧化 0.2mol 放出 5.5
【解析】(1)二氧化氮转化成四氧化二氮反应是可逆反应,且正反应是放热反应.将混合气体的烧瓶分别侵入冷水和热水中,观察到浸入冰水中的烧瓶里的气体混合物颜色变浅,说明二氧化氮浓度减小,四氧化二氮浓度增加,原平衡状态被破坏,平衡向正反应方向移动,即向放热反应方向移动;而浸入热水中的烧瓶中气体混合物颜色变深,说明二氧化氮浓度增加,四氧化二氮浓度减小,同样破坏了原平衡状态,说明平衡向逆反应方向移动.可见,当条件改变时,原来的化学平衡将被破坏,并在新的条件下建立新的平衡.即发生了化学平衡移动.
(2)根据反应Cu+2Fe3+=Cu2++2Fe2+,Cu失电子是还原剂发生氧化反应,原电池中做负极,故负极材料应选用Cu,发生氧化反应,电极反应式为:Cu—2e-=Cu2+,负极电极质量减轻了6.4g,反应的n(Cu)=0.1mol,故转移电子的物质的量是0.2mol;
(3)1mol氢气和1mol碘蒸气反应生成2molHI,根据键能计算(436+151-2![]() ),放出11 kJ的热量,故生成1molHI放出5.5 kJ的热量。
),放出11 kJ的热量,故生成1molHI放出5.5 kJ的热量。


科目:高中化学 来源: 题型:
【题目】某些有机化合物之间具有如下转化关系:
其中A是一种五元环状化合物,其分子中只有一种化学环境的氢原子;F核磁共振氢谱显示有三种化学环境的氢原子,且峰面积之比为2:2:3.
已知:① 
![]() 2RCOOH(其中R是羟基)
2RCOOH(其中R是羟基)
②R﹣COOH ![]() R﹣CH2OH(其中R是羟基)
R﹣CH2OH(其中R是羟基)
(1)G是合成顺丁橡胶的主要原料,G的名称是 . B中含氧官能团的名称是
(2)A的结构简式是
(3)⑥的化学方程式是
(4)E在一定条件下能够发生缩聚反应,其中主链上含“﹣CH2﹣”的高聚物的结构简式是 . 有机物Y与E互为同分异构体,且具有相同的官能 团种类和数目,则Y的结构可有种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol SO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡:2SO2+O22SO3测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时各物质的浓度;
(2)平衡时SO2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D 原子序数依次增加,X、Y、Z、W是由这四种元素中的两种元素组成的常见化合物,X为有刺激性气味的气体,Y为淡黄色固体,甲是由C元素形成的气体单质,乙为红棕色气体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略)。下列说法正确的是

A. 原子半径大小顺序:D>C>B>A B. 最简单气态氢化物的稳定性:B>C
C. 图示转化关系涉及的反应均为氧化还原反应 D. 元素C、D形成的化合物中一定只含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习和研究离不开元素周期表。下表为元素周期表的一部分,表中①-⑩分别代表一种元素。回答下列问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||
3 | ⑧ | ⑨ | ⑩ |
(1)上述元素中,有一种元素在自然界中形成的物质种类最多,该元素在周期表中的位置是_______。
(2)⑧、⑨、⑩元素的离子半径由大到小的顺序为________________(用离子符号表示)。
(3)写出由①、⑥、⑧三种元素形成的一种离子化合物的电子式__________________。
(4)上述元素中有一种元素的氧化物和氢氧化物都有两性,面出该元素的原子结构示意图______________;高温条件下,该元素的单质与铁红能发生反应,此反应常用于野外焊接钢轨,则该反应的能量变化可用图__________________表示。(填“甲“或“乙”)
(5)知W+X→Y+Z,且W、X、Y、Z分别是由①、⑤、⑥三种元素中的两种形成的10电子粒子,写出并配平上述反应式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如下图所示,对该反应的推断合理的是( )
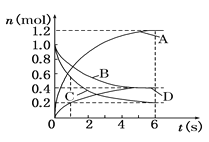
A. 该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B. 反应进行到1 s时,v(A)=v(D)
C. 反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D. 反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于2mol二氧化碳的叙述中,正确的是( )
A. 质量为44g B. 含有4mol O C. 分子数为6.02×1023 D. 共有3mol原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com