
| A. | NO2 | B. | NO | C. | N2 O | D. | N2O3 |
分析 根据题给信息知,FeS2和HNO3的反应中生成硝酸铁、硫酸和氮氧化物,根据氧化还原反应中得失电子数相等确定氮氧化物的化学式.
解答 解:根据题给信息知,FeS2和HNO3的反应中生成硝酸铁、硫酸和氮氧化物,FeS2和HNO3的物质的量之比是1:8,
设二者的物质的量分别为1mol、8mol,
由质量守恒可知生成1molFe(NO3)3、2molH2SO4,
则起酸作用的硝酸为3mol,所以作氧化剂的硝酸为5mol,
反应共失去电子的物质的量为1mol×(3-2)+2mol×[6-(-1)]=15mol,
设氮氧化物中N元素的化合价是X,则得到的电子总数=(5-x)×5=15,所以x=2,即氮氧化物的化学式为NO,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,明确元素化合价是解本题的关键,注意从得失电子数目相等角度解答该题,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滤液中一定有Cu2+ | B. | 滤液中一定无Cu2+ | ||
| C. | 滤液中一定有Fe3+ | D. | 滤液中一定无Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇 | B. | 醋酸 | C. | 一氯甲烷 | D. | 三氯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 、G
、G .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
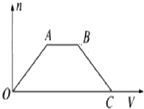 将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系如图,图中AB段表示的离子方程式是( )
将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系如图,图中AB段表示的离子方程式是( )| A. | ②⑤ | B. | ⑤④ | C. | ④② | D. | ④① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
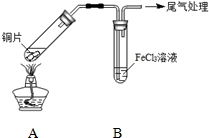 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.| 步骤① | 配制1mol•L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A. |
| 步骤② | 往5mL 1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO和Al2O3均只能与酸反应,不能与碱反应 | |
| B. | Na和Fe在一定条件下与水反应都生成H2和对应的碱 | |
| C. | Mg和Al都可以用电解法冶炼得到 | |
| D. | Na2O和Na2O2与CO2反应产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不变 | B. | 混合气体的平均相对分子质量不变 | ||
| C. | v正(CO)=2v逆(H2) | D. | CO(g)、CH3CH2OH(g)的分子数之比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com