
【题目】室温下,向100mL饱和的H2S溶液中通入SO2气体(气体体积换算成标准状况),发生反应:2H2S+SO2=3S↓+2H2O,测得溶液pH与通入SO2的关系如图所示。下列有关说法错误的是( )
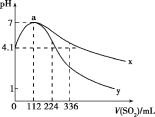
A.a点水的电离程度最大
B.该温度下H2S的Ka1≈10-7.2
C.曲线y代表继续通入SO2气体后溶液pH的变化
D.a点之后,随SO2气体的通入,![]() 的值始终减小
的值始终减小
【答案】D
【解析】
A选项,由题图可知,a点表示通入SO2气体112mL(即0.005mol)时pH=7,说明SO2气体与H2S溶液恰好完全反应,溶液呈中性,a点之前为H2S过量,a点之后为SO2过量,溶液均呈酸性,故a点水的电离程度最大,故A正确;
B选项,由题图中曲线的起点可知,a点溶液呈中性,说明SO2气体与H2S溶液恰好完全反应,由此可知饱和H2S溶液中溶质的物质的量为0.01mol,c(H2S)=0.1mol/L,0.1mol/LH2S溶液电离出的c(H+)=10-4.1 mol/L,电离方程式为H2S![]() H++HS-、HS-
H++HS-、HS-![]() H++S2-;以第一步为主,根据平衡常数表达式计算出该温度下H2S的Ka1≈
H++S2-;以第一步为主,根据平衡常数表达式计算出该温度下H2S的Ka1≈![]() ≈10-7.2,故B正确;
≈10-7.2,故B正确;
C选项,当通入SO2气体336mL时,物质的量为0.015mol,反应后相当于溶液中的c(H2SO3)=0.1mol/L,因为H2SO3的酸性强于H2S,故此时溶液对应的pH应小于4.1,故曲线y代表继续通入SO2气体后溶液pH的变化,故C正确;
D选项,根据平衡常数表达式可知![]() =
=![]() ,a点之后,随SO2气体的通入,c(H+)增大,当通入的SO2气体达饱和时,c(H+)不再变化,故D错误。
,a点之后,随SO2气体的通入,c(H+)增大,当通入的SO2气体达饱和时,c(H+)不再变化,故D错误。
综上所述,答案为D。


科目:高中化学 来源: 题型:
【题目】.二氧化碳的回收利用对温室气体的减排具有重要的意义。在2L密闭容器中,加入2.00 mol CO2和2.00 mol H2以及催化剂发生反应:CO2(g)+H2(g) ![]() HCOOH(g) △H,测得,n(H2)/mol在不同温度随时间的变化如下表:
HCOOH(g) △H,测得,n(H2)/mol在不同温度随时间的变化如下表:
实验编号 | 时间/min | 60 | 90 | 120 | 150 | 180 |
Ⅰ | T1/K | 1.50mol | 1.32 mol | 1.28 mol | 1.26 mol | 1.26 mol |
Ⅱ | T2/K | 1.45mol | 1.20 mol | 1.10 mol | 1.10 mol | 1.10 mol |
(1)实验I中0~60min内用HCOOH表示的该反应的平均反应速率为____________。
(2)实验II反应开始时体系压强为P0,第90min时体系压强为P1,则P1:P0=_______。
(3)T2温度下反应的平衡常数为______________。
(4)比较实验温度T1____T2(填“>”或“<”),该反应的△H____0(填“>”、“=”或“<”)。
(5)下列说法正确的是_______(填编号)。
A.当CO2、H2和HCOOH的物质的量浓度之比为1:1:1时,该反应达到平衡
B.容器中气体密度不再改变,不能判断该反应是否达到平衡
C.将HCOOH液化后分离既能提高转化率又能加快反应速率
D.选用更高效的催化剂可提高生产效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,实验现象及结论都正确且两者具有因果关系的是
实验 | 现象 | 结论 | |
A | 向Ba(NO3)2溶液中通入二氧化硫气体 | 有白色沉淀生成 | SO2与Ba(NO3)2反应得到BaSO3 |
B | 向FeI2的溶液中滴加少量的氯水 | 溶液颜色变深 | Cl2与Fe2+反应生成Fe3+ |
C | 向蔗糖溶液中加几滴稀硫酸,水浴加热5min后,再加新制Cu(OH)2后加热 | 无砖红色沉淀生成 | 蔗糖没有水解 |
D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)___I1(Cu)(填“大于”或“小于”)。
(2)基态Fe2+的电子排布式为___。
(3)在N、Mg、Al、Si四种元素中,有一种元素的电离能数据如下:
电离能 | I1 | I2 | I3 | I4 | … |
I0/kJ·mol-1 | 578 | 1817 | 2745 | 11575 | … |
则该元素的元素符号是___。
(4)NO3-的空间构型__(用文字描述),SO42-中硫原子的杂化方式为___。
(5)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是___、中心原子的杂化形式为___。根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是___。
(6)与O3分子互为等电子体的一种阴离子为___(填化学式)。
(7)N2分子中σ键与π键的数目比n(σ):n(π)=___。
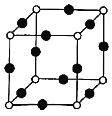
(8)Cu、N两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是___(用元素符号表示);若晶胞的棱长a nm,阿伏加德罗常数为NA,则该晶体的密度为___g/cm3(用含a、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学常用的酸碱指示剂酚酞的结构简式如图所示,下列关于酚酞的说法错误的是( )
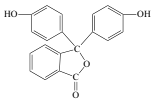
A.酚酞的分子式为C20H14O4
B.酚酞具有弱酸性,且属于芳香族化合物
C.1mol酚酞最多与2molNaOH发生反应
D.酚酞在碱性条件下能够发生水解反应,呈现红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列表示物质变化的化学用语中正确的是( )
A. 汽车用的铅蓄电池充电时阳极反应:PbSO4+2H2O-2e-=PbSO4+4H++SO42-
B. 利用Na2CO3溶液可除油污:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C. BaSO4的水溶液导电性极弱: BaSO4![]() Ba2++SO42-
Ba2++SO42-
D. 用醋酸除去暖瓶中的水垢:2H++ CaCO3=Ca2++CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取Na2CO3和高纯Si的工艺流程如图所示,下列说法错误的是
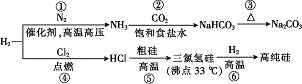
A. 反应①属于固氮反应
B. 步骤②为先向饱和食盐水中通入CO2至饱和后,再通入NH3
C. 反应⑤、⑥均为氧化还原反应
D. 用精馏的方法可提纯三氯氢硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制0.2 molL-1的碳酸钠溶液250 mL。
(1)根据计算需取___________克无水碳酸钠固体
(2)需要使用的主要仪器有托盘天平,____________、____________、_____________、____________和___________;
(3)下列操作对所配制溶液的浓度有何影响(填偏高、偏低或无影响)
①碳酸钠固体未充分干燥______________;
②容量瓶用碳酸钠溶液洗涤_____________;
③转移溶液时容量瓶中有少量的蒸馏水__________;
④定容时仰视读数_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列叙述正确的是
A. 18 g D2O中含有的质子数为10NA
B. 60 g二氧化硅中含有的Si—O键数目为4NA
C. 密闭容器中,2 mol NO与1 mol O2充分反应,产物的分子数为2NA
D. 标准状况下,22.4 L氯气通入足量水中充分反应后转移电子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com