
 .
. .
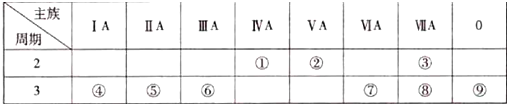
.分析 由元素在周期表中位置,可知①为C、②为N、③为F、④为Na、⑤为Mg、⑥为Al、⑦为S、⑧为Cl、⑨为Ar.
(1)表中化学性质最不活泼的元素为Ar,原子核外有18个电子,各层电子数为2、8、8;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(3)元素④和⑥的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水;
(4)元素④与元素⑧形成的化合物为NaCl,由钠离子与氯离子构成;
(5)高氯酸的酸性最强;
(6)同周期自左而右非金属性减弱;根据金属与酸置换出氢气的难易程度、金属之间的置换反应、其最高价氧化物的水化物碱性强弱等判断金属性强弱.
解答 解:由元素在周期表中位置,可知①为C、②为N、③为F、④为Na、⑤为Mg、⑥为Al、⑦为S、⑧为Cl、⑨为Ar.
(1)表中化学性质最不活泼的元素为Ar,原子核外有18个电子,原子结构示意图为: ,
,
故答案为: ;
;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:S>Cl>F,
故答案为:S>Cl>F;
(3)元素④和⑥的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)元素④与元素⑧形成的化合物为NaCl,由钠离子与氯离子构成,电子式为: ,
,
故答案为: ;
;
(5)高氯酸的酸性最强,高氯酸的化学式为:HClO4,
故答案为:HClO4;
(6)同周期自左而右非金属性减弱,故金属性Mg>Al,
A.Mg、Al两种元素在空气中久置,金属表面有氧化物膜,分别放入热水中,不能根据反应判断金属性强弱,故A错误;
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应,反应越剧烈,说明金属性越强,故B正确;
C.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液,溶液碱性越强,说明金属性越强,故C正确;
D.二者都是金属,没有气态氢化物,不能比较氢化物的稳定性判断金属性强弱,故D错误,
故答案为:镁;BC.
点评 本题考查元素周期表、元素周期律、常用化学用语等,难度不大,注意整体把握元素周期表,掌握金属性、非金属性强弱比较实验事实.


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | ①⑥⑦ | B. | ③⑤⑧ | C. | ③⑦⑧ | D. | ③⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③⑤ | C. | ②④⑤ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+O2(g)═CO(g);△H=-393.5 kJ/mol | |
| B. | 2H2(g)+O2(g)═2H2O(g);△H=+571.6 kJ/mol | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-890.3 kJ/mol | |
| D. | $\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2 (g)+3H2O(l);△H=-1400 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用已知浓度NaOH溶液滴定未知浓度盐酸,滴定终点时,俯视刻度线,则测得盐酸浓度偏小 | |
| B. | 用新制氢氧化铜悬浊液可以鉴别乙酸、葡萄糖和淀粉三种溶液 | |
| C. | 通常采用产生气泡的快慢,来比较不同条件下Na2S2O3溶液与稀硫酸的反应速率 | |
| D. | 受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
| 四 | (11) | (12) | (13) | ||||
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com