
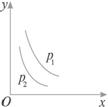
A.上述反应是放热反应 B.上述反应是吸热反应
C. a>b D. d<b
科目:高中化学 来源: 题型:
| A、两种物质反应,不管怎样书写化学方程式,平衡常数不变 | ||
B、某温度下,2L密闭容器中加入4mol A和2mol B发生反应:3A(g)+2B(g)?4C(s)+2D( g).平衡时测得n(C)=1.6mol,反应的化学平衡常数表达式为K=
| ||
| C、温度一定时,当溶液中(Ag+)?c(Cl-)等于Ksp值时,此溶液为AgCl的饱和溶液 | ||
| D、难溶电解质AB2饱和溶液中,c(A2+)=x mol?L-1,c(B-)=y mol?L-1,则Ksp值为4xy2 |
查看答案和解析>>
科目:高中化学 来源:选修高手化学苏教·化学反应原理 苏教版 题型:021
|
当反应L(s)+aG(g)
| |
A. |
上述反应是放热反应 |
B. |
上述反应是吸热反应 |
C. |
a>b |
D. |
d<b |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)Cl-、![]() 谁先沉淀?
谁先沉淀?
(2)当刚出现Ag2CrO4沉淀时,溶液中Cl-浓度是多少?(设混合溶液在反应中体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
难溶化合物的饱和溶液存在溶解平衡,例如:AgCl(s)![]() Ag++Cl-,Ag2CrO4(s)
Ag++Cl-,Ag2CrO4(s) ![]() 2Ag++
2Ag++![]() 。在一定温度下,已知:Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8×10-10,Ksp(Ag2CrO4)=[c(Ag+)]2·c(
。在一定温度下,已知:Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8×10-10,Ksp(Ag2CrO4)=[c(Ag+)]2·c(![]() )=1.9×10-12,现用0.01 mol·L-1 AgNO3溶液滴定0.01 mol·L-1 KCl和0.001 mol·L-1 K2CrO4混合溶液,通过计算回答:
)=1.9×10-12,现用0.01 mol·L-1 AgNO3溶液滴定0.01 mol·L-1 KCl和0.001 mol·L-1 K2CrO4混合溶液,通过计算回答:
(1)Cl-、![]() 谁先沉淀?
谁先沉淀?
(2)当刚出现Ag2CrO4沉淀时,溶液中Cl-的物质的量浓度是多少?(设混合溶液在反应中体积不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com