
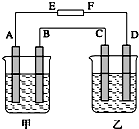
 在如图中,甲烧杯中盛有100mL 0.50mol?L-1 AgNO3溶液,乙烧杯中盛有100mL 0.25mol?L-1CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9g,则
在如图中,甲烧杯中盛有100mL 0.50mol?L-1 AgNO3溶液,乙烧杯中盛有100mL 0.25mol?L-1CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9g,则

科目:高中化学 来源: 题型:
| A、③④⑤ | B、①③④⑤ |
| C、②③④⑤⑥ | D、①③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化碳 | B、一氧化碳 |
| C、二氧化硫 | D、可吸入颗粒物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
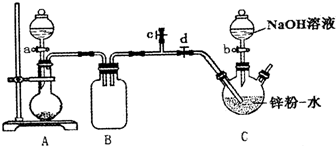 保险粉(Na2S2O4)有极强的还原性,遇水或在潮湿空气中会分解发热,甚至引起燃烧,但在碱性环境下较稳定.某实验小组利用如图装置制取保险粉,并验证其还原性.在35~45℃下,将SO2气体通入锌粉-水悬浮液中,生成ZnS2O4;待反应完全后,冷却至室温,向三颈烧瓶中加入18%的NaOH溶液,生成Na2S2O4和Zn(OH)2;经一系列操作获得无水Na2S2O4样品.
保险粉(Na2S2O4)有极强的还原性,遇水或在潮湿空气中会分解发热,甚至引起燃烧,但在碱性环境下较稳定.某实验小组利用如图装置制取保险粉,并验证其还原性.在35~45℃下,将SO2气体通入锌粉-水悬浮液中,生成ZnS2O4;待反应完全后,冷却至室温,向三颈烧瓶中加入18%的NaOH溶液,生成Na2S2O4和Zn(OH)2;经一系列操作获得无水Na2S2O4样品.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用石墨做电极时,首先在阴极放电的是Cl- |
| B、用石墨做电极时,电解一段时间后H+有可能在阴极放电 |
| C、用铁做电极时,阳极反应式:2Cl--2e-=Cl2↑ |
| D、用石墨做电极时,开始电解时Cl-与H+首先放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
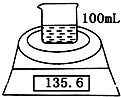 如图是测定镁粉(含铝粉)的纯度的实验装置.所用的NaOH浓度为4.6mol?L-1.
如图是测定镁粉(含铝粉)的纯度的实验装置.所用的NaOH浓度为4.6mol?L-1.| 实验操作 | 时间/min | 电子天平的读数/g |
| 烧杯+NaOH溶液 | 120 | |
| 烧杯+NaOH溶液+样品 | 0 | 135.6 |
| 1 | 135.1 | |
| 2 | 134.7 | |
| 3 | 134.4 | |
| 4 | 134.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com