
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2反应得到,化学方程式为
2NO(g)+Cl2(g) ![]() 2ClNO(g)
2ClNO(g)
(1)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) ΔH1 K1
NaNO3(s)+ClNO(g) ΔH1 K1
②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2Cl2(g)+2NO(g) ΔH2 K2
2NaNO3(s)+2Cl2(g)+2NO(g) ΔH2 K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH3 K3
2ClNO(g) ΔH3 K3
ΔH1 、ΔH2 、ΔH3 之间的关系式为______;平衡常数K1、K2、K3之间的关系式为_______。
(2)已知几种化学键的键能数据如下:
化学键 | NO中的氮氧键 | Cl-Cl键 | Cl-N键 | ClNO中的N=O键 |
键能/(KJ/mol) | 630 | 243 | a | 607 |
则ΔH3+2a=_________。
(3)300℃时,2ClNO(g)![]() 2NO(g)+Cl2(g)的正反应速率的表达式为v正=k·cn(ClNO)(k为速率常数,只与温度有关),测得塑料厂与浓度关系如下表所示:
2NO(g)+Cl2(g)的正反应速率的表达式为v正=k·cn(ClNO)(k为速率常数,只与温度有关),测得塑料厂与浓度关系如下表所示:
序数 | c(ClNO)/(mol/L) | v/(mol·L·s) |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
③ | 0.90 | 3.24×10-8 |
n=___________,k=____________。
(4)在两个容积均为2L的恒容密闭容器中分别加入4mol和2mol ClNO,在不同温度下发生反应:2ClNO(g) ![]() 2NO(g)+Cl2(g),达道平衡时ClNO的浓度随温度变化的曲线如图所示(图中ABC点均位于曲线上)。
2NO(g)+Cl2(g),达道平衡时ClNO的浓度随温度变化的曲线如图所示(图中ABC点均位于曲线上)。

①2ClNO(g) ![]() 2NO(g)+Cl2(g) ΔS____0(选填“>”“<”或“=”)。
2NO(g)+Cl2(g) ΔS____0(选填“>”“<”或“=”)。
②A、B两点平衡常数之比为K(A):K(B)=_____。
③B、C两点ClNO的转化率a(B)______a(C) (选填“>”“<”或“=”)。
(5)在催化剂作用下NO和CO转化为无毒气体:
2CO(g)+2NO(g) ![]() 2CO2(g)+N2(g) ΔH=-748KJ/mol
2CO2(g)+N2(g) ΔH=-748KJ/mol
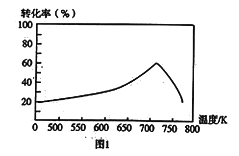
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是___________。
②已知:测定空气中NO和CO含量可用电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为______。

【答案】 ΔH3+ΔH2=2ΔH1 K2·K3=K12 289KJ/mol 2 4.0×10-8L·mol-1·s-1 > 1:27 < 温度升高710K时,反应达到平衡状态,由于该反应时放热反应,升高温度,平衡逆向移动,氮氧化物转化率降低 CO-2e-+H2O=CO2+2H+
【解析】本题分析:本题主要考查有关化学平衡的计算。
(1)2①-②=③,ΔH1 、ΔH2 、ΔH3 之间的关系式为ΔH3+ΔH2=2ΔH1;平衡常数K1、K2、K3之间的关系式为K2·K3=K12。
(2)ΔH=反应物键能-生成物键能。ΔH3=[2×630+243-2×(a+607)]kJ/mol,
则ΔH3+2akJ/mol =289kJ/mol 。
(3)将两组数据代入 v正=k·cn(ClNO),得 n=2,k=4.0×10-8L·mol-1·s-1。
(4)①该反应气体物质的量增大,所以ΔS>0。
②B点和A点所在曲线分别加入4mol和2mol ClNO,K=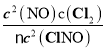 ,A点ClNO、NO、Cl2 的浓度分别是0.5mol/L、0.5mol/L、0.25mol/L,B点ClNO、NO、Cl2的浓度分别是0.5mol/L、1.5mol/L、0.75mol/L,平衡常数之比为K(A):K(B)=1:27。
,A点ClNO、NO、Cl2 的浓度分别是0.5mol/L、0.5mol/L、0.25mol/L,B点ClNO、NO、Cl2的浓度分别是0.5mol/L、1.5mol/L、0.75mol/L,平衡常数之比为K(A):K(B)=1:27。
③B点减压得到C点,减压平衡右移,所以B、C两点ClNO的转化率a(B)<a(C) 。
(5)①当温度升高至710K时,反应达到平衡状态,由于该反应是放热反应,升高温度,平衡逆向移动,氮氧化物转化率降低 。
②CO传感器的工作电极的反应式为CO-2e-+H2O=CO2+2H+。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】(1)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
为测定产品纯度,进行了如下实验:准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为:2S2O32+I2==S4O62+2I-

请填写下列空白:
①用标准碘溶液滴定待测溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____________________。滴定至终点时,溶液颜色________,且半分钟内保持不变,即停止滴定。
②测定起始和终点的液面位置如图,则消耗碘的标准溶液体积为________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________________________________
③下列操作中可能使所测产品的纯度数值偏低的是________(填字母)。
A.酸式滴定管未用标准碘溶液润洗就直接注入标准碘溶液
B.滴定前,锥形瓶用蒸馏水洗涤后,未用待测的溶液润洗就做滴定
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取标准碘溶液体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
(2)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为________,滴定反应的离子方程式为________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,请按要求完成下列题目。
(1)对反应NH3+O2——NO+H2O(未配平)作分析,并用单线桥法标出电子转移的方向和数目: ______________________________。该反应中,________是还原剂,________是还原产物,被还原的物质是________。
(2)在一定条件下,反应2NH3+3CuO![]() 3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是______。
3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是______。
①该反应是置换反应
②反应中NH3被氧化为N2
③在反应中体现了金属铜的还原性
④在反应中每生成1 mol H2O转移1 mol电子
(3)在反应2H2S+SO2![]() 3S+2H2O中被氧化的元素与被还原的元素的质量比为 ________。
3S+2H2O中被氧化的元素与被还原的元素的质量比为 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2MOyx-+5S2-+16H+=2M2++5S↓+8H2O,则MOyx-中的M的化合价为
A. +3 B. +4 C. +6 D. +7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧和硫是同主族元素,下列事实不能说明氧的非金属性比硫强的是
A. 酸性:H2S>H2O B. 热稳定性:H2O>H2S
C. 原子半径:S>O D. 化合价:SO2中S为正价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室加热浓H2SO4和乙醇混合液制乙烯。有关说法正确的是
A. 向烧瓶中依次加入碎瓷片、浓H2SO4和酒精
B. 用温度计测量生成气体的温度
C. 温度过高时制得的乙烯中混有SO2
D. 用排气法收集乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和O2在一定条件下发生化合反应生成气体B,反应掉O2体积是反应掉N2的体积的1.5倍(同温同压),则B分子的组成是( )
A. N2O B. N2O3 C. NO2 D. N2O4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com