
【题目】某市医学院研发出一种新型的补铁药品.该药品的有效成分是琥珀酸亚铁(暗黄色,难溶于水,易溶于HCl).为了检测该药品中的Fe2+ , 某学习小组设计了如图实验步骤: 
(1)A溶液中溶质的化学式是 . 加入A溶液后,不等加入新制氯水就产生浅红色的原因是 . 加入新制氯水之后的变化用离子方程式表示是 , 因产生Fe3+ , 溶液变成血红色.
(2)生成的血红色溶液放置时间过长,会最终褪色.甲同学猜想是Fe3+被还原成Fe2+导致褪色.证明甲同学的猜想不合理的实验操作是取少量褪色溶液,滴加 , 观察到现象即可证明.
(3)乙同学为检测药品中Fe的含量,设计并进行了如下实验: ①取样、碾碎,精确称取2.0g,加入过量盐酸,搅拌使其完全溶解;
②向所得溶液中加入过量H2O2溶液,再加入氨水至不再产生沉淀;
③将所得固体灼烧至恒重,得到0.8g纯净的红棕色粉末.
则该药品中铁的质量分数为 .
【答案】
(1)KSCN;有少量Fe2+被空气中的氧气氧化为Fe3+;2Fe2++Cl2=2Fe3++2Cl﹣
(2)新制氯水;溶液颜色没有变化
(3)28%
【解析】解|:该药品的有效成分是琥珀酸亚铁(暗黄色,难溶于水,易溶于HCl),药片碾碎后加入试剂1为盐酸后溶液为浅绿色,加入A溶液变化为浅红色溶液,加入新制氯水得到血红色溶液,说明A为KSCN溶液,不等加入新制氯水就产生浅红色说明空气中氧气氧化亚铁离子为铁离子,(1)分析可知A溶液中溶质为KSCN,加入A溶液后不等加入新制氯水就产生浅红色的原因是:有少量Fe2+被空气中的氧气氧化为Fe3+,加入新制氯水之后变为血红色是氯气氧化亚铁离子为铁离子,结合SCN﹣离子生成血红色溶液,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl﹣,
所以答案是:KSCN; 有少量Fe2+被空气中的氧气氧化为Fe3+;2Fe2++Cl2=2Fe3++2Cl﹣;(2)甲同学猜想是Fe3+被还原成Fe2+导致褪色,再滴入氯水若出现血红色证明合理,若不变红色则不合理,证明甲同学的猜想不合理的实验操作是取少量褪色溶液,滴加新制氯水,溶液颜色没有变化,证明甲同学的猜想不合理,
所以答案是:新制氯水;溶液颜色没有变化;(3)③将所得固体灼烧至恒重,得到0.8g纯净的红棕色粉末为氧化铁,结合铁元素守恒计算,
铁元素物质的量= ![]() ×2=0.01mol,
×2=0.01mol,
该药品中铁的质量分数= ![]() ×100%=28%,
×100%=28%,
所以答案是:28%


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列常见物质的俗名与化学式对应关系正确的是
A.烧碱——NaOHB.明矾——Al2(SO4)3
C.石膏——CaCO3D.小苏打——Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B . [实验化学]
1﹣溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36gcm﹣3 . 实验室制备少量1﹣溴丙烷的主要步骤如下:
步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20mL水,冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24g NaBr.
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止.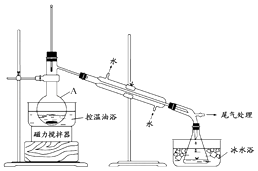
步骤3:将馏出液转入分液漏斗,分出有机相.
步骤4:将分出的有机相转入分液漏斗,依次用12mL H2O、12mL 5% Na2CO3溶液和12mL H2O洗涤,分液,得粗产品,进一步提纯得1﹣溴丙烷.
(1)仪器A的名称是;加入搅拌磁子的目的是搅拌和 .
(2)反应时生成的主要有机副产物有2﹣溴丙烷和 .
(3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是 .
(4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是 .
(5)步骤4中用5%Na2CO3溶液洗涤有机相的操作:向分液漏斗中小心加入12mL 5% Na2CO3溶液,振荡, , 静置,分液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)Li4Ti3O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为Fe TiO3 , 还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示.由图可知,当铁的净出率为70%时,所采用的实验条件为 . 
(2)“酸浸”后,钛主要以TiOCl42﹣形式存在,写出相应反应的离子方程式 .
(3)TiO2xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2xH2O转化率最高的原因 .
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为 .
(5)若“滤液②”中c(Mg2+)=0.02molL﹣1 , 加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10﹣5 , 此时是否有Mg3(PO4)2沉淀生成?(列式计算).FePO4、Mg3(PO4)2的分别为1.3×10﹣22、1.0×10﹣24
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体.实验室由芳香化合物A制备H的一种合成路线如下: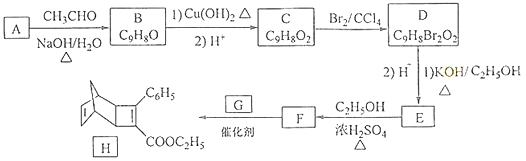
已知:①RCHO+CH3CHO ![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
② ![]() +
+ ![]()
![]()
![]()
回答下列问题:
(1)A的化学名称为为 .
(2)由C生成D和E生成F的反应类型分别为、 .
(3)E的结构简式为 .
(4)G为甲苯的同分异构体,由F生成H的化学方程式为 .
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2 , 其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1,写出2种符合要求的X的结构简式 .
(6)写出用环戊烷和2﹣丁炔为原料制备化合物 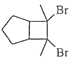 的合成路线(其他试剂任选).
的合成路线(其他试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应前后肯定没有变化的是
①原子数 ②分子数 ③元素种类 ④物质的总质量 ⑤物质的种类 ⑥共价键数
A. ②④⑥B. ①③④C. ①③⑤D. ①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸在溶剂中的电离实质是酸中的H+转移给溶剂分子,如HCl+H2O=H3O++Cl﹣ . 已知H2SO4和HNO3在冰醋酸中的电离平衡常数Ka1(H2SO4)=6.3×10﹣9 , Ka(HNO3)=4.2×10﹣10 . 下列说法正确的是( )
A.冰醋酸中H2SO4的电离方程式:H2SO4+2CH3COOH=SO42﹣+2CH3COOH2+
B.H2SO4的冰醋酸溶液中:c(CH3COOH2+)=c(HSO4﹣)+2c(SO42﹣)+c(CH3COO﹣)
C.浓度均为0.1mol?L﹣1的H2SO4或HNO3的冰醋酸溶液:pH(H2SO4)>pH(HNO3)
D.向HNO3的冰醋酸溶液中加入冰醋酸, ![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式如下:  .下列叙述正确的是( )
.下列叙述正确的是( )
A.有机物A属于芳香烃
B.有机物A可以和Br2的CCl4溶液发生加成反应
C.有机物A和浓硫酸混合加热170℃时,可以发生消去反应
D.1mol A和足量的NaOH溶液反应,可以消耗2mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热
B.酸和碱发生中和反应生成1mol水,这时的反应热叫中和热
C.燃烧热或中和热都是反应热的种类之一
D.其他条件一样时,氢气与氧气反应生成液态水和气态水时所放出的热量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com