
| A | C | |
| B |


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
| A、1:10 | B、1:5 |
| C、1:2 | D、2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)═2H2O(g)△H=+484 kJ?mol-1 |
| B、H2O(g)═H2(g)+O2(g)△H=+242 kJ?mol-1 |
| C、H2(g)+O2(g)═H2O(g)△H=+242 kJ?mol-1 |
| D、2H2(g)+O2(g)═2H2O(l)△H=-484 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25°时,有pH=a的醋酸溶液,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B、向2.0mL浓度均为0.1mol?L-1的KCl、KI混合液滴加1~2滴0.01 mol?L-1AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小 |
| C、0.2mol/L的一元酸HX与0.1mol/L的KOH溶液等体积混合所得溶液中,一定有:c(H+)+c(K+)═c(OH-)+c(X-) |
| D、25°时,0.2mol?L-1盐酸与等体积0.05mol?L-1Ba(OH)2溶液混合后,溶液pH为1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
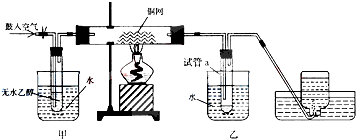
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH2CH2CH2CH2CH3 |
B、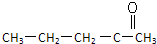 |
| C、CH2═CH-CH═CH2 |
| D、(CH3)3C-C≡C-CH=CHCH3CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小苏打用于治疗胃溃疡病人的胃酸过多症 |
| B、电解从海水中得到的氯化钠溶液可获得金属钠 |
| C、FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板 |
| D、铝制容器不能盛放酸性或碱性食品,但可长期盛放腌制食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
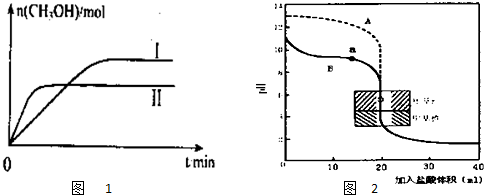
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com