
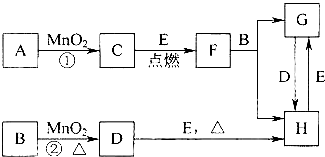
| ||
| ||
| ||
| ||
| ||



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| X | Z | M | R | Q | ||
| ԭ�Ӱ뾶/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| ��Ҫ���ϼ� | -4��+4 | -2 | -1��+7 | +3 | ||
| ���� | �����Ӻ������� | ���ǽ������ϵ����� | ��ɫ��Ӧ�ʻ�ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A��M�ķ���ʽΪC6H12O6 |
| B��N�Ľṹ��ʽΪCH3COOH |
| C��M���Է���ˮ�ⷴӦ |
| D������������N���ܺ�NaOH��Һ������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ij�о�С����ʵ����̽����������泥�H2NCOONH4��ˮ�ⷴӦ���ʵIJⶨ�ͷֽⷴӦƽ�ⳣ����
ij�о�С����ʵ����̽����������泥�H2NCOONH4��ˮ�ⷴӦ���ʵIJⶨ�ͷֽⷴӦƽ�ⳣ����| �¶ȣ��棩 | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| ƽ����ѹǿ��kPa�� | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| ƽ��������Ũ�� ����10-3mol/L�� | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ȥ���б��ӣ�������ˮ����� |
| B�����뱽���屽����ˮ���Һ |
| C����ȥ�������������ᣬ���뱥��NaOH��Һ�����ú��Һ |
| D���������ᡢ��ȩ���Ҵ�������Cu��OH��2����Һ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ij��������������������������Ư�ۣ��ó�������Ʒ˵������ͼ��ʾ��
ij��������������������������Ư�ۣ��ó�������Ʒ˵������ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A���ö��Ե缫���MgCl2��Һʱֻ������2Cl-+2H2O
| ||||
| B���ں���nmolFeBr2��Һ��ͨ��nmolCl2��2Fe2++2Br-+2Cl2=2Fe3++Br2+2Cl- | ||||
| C����Ca��HCO3��2��Һ�м��뺬�����ʵ�����NaOH��Һ��Ca2++2HCO3-+2OH-=CaCO3��+CO32-+2H2O | ||||
| D������������NaOH��Һ�У�2Al+2OH-+2H2O=2AlO2-+3H2�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com