
 | IA | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| 2 | �� | �� | ||||||
| 3 | �� | �� | �� | �� | �� | �� | �� | |
| 4 | �� | ⑪ | ⑫ |
 ��⑪
��⑪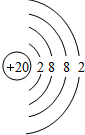 ��
������ ��1����Ԫ�������ڱ���λ�ÿ�֪����ΪN����ΪF����ΪNa����ΪMg����ΪAl����ΪSi����ΪS����ΪCl����ΪAr����ΪK��⑪ΪCa��⑫ΪBr��
��2����ΪAl��ԭ�Ӻ�����13�����ӣ���3�����Ӳ㣬���������Ϊ2��8��3��
⑪ΪCa��ԭ�Ӻ�����20�����ӣ���4�����Ӳ㣬���������Ϊ2��8��8��2��
��3��ͬ����������ҽ����Լ������ǽ�������ǿ��ͬ�������϶��½�������ǿ���ǽ����Լ�����ϡ������ԭ�������Ϊ�ȶ��ṹ����ѧ��������ã�
��4��ͬ����������ҷǽ�������ǿ�����ݵ�����������Ӧ�����׳̶ȡ����ҳ̶��жϣ������⻯���ȶ��ԡ���ۺ���������ԡ�����֮�����û�����������Ԫ�ػ��ϼ۵��жϷǽ�����ǿ����
��5������������ԭ�Ӱ뾶����Ԫ��ΪNa��ͬ������ԭ�Ӱ뾶��С��Ԫ��ΪCl�������γ�NaCl��
��6����ΪSi����������ΪSiO2�����й��ۼ���
��� �⣺��1����Ԫ�������ڱ���λ�ÿ�֪����ΪN����ΪF����ΪNa����ΪMg����ΪAl����ΪSi����ΪS����ΪCl����ΪAr����ΪK��⑪ΪCa��⑫ΪBr��
�ʴ�Ϊ��Mg��Br��
��2����ΪAl��ԭ�Ӻ�����13�����ӣ���3�����Ӳ㣬���������Ϊ2��8��3��ԭ�ӽṹʾ��ͼΪ ��
��
⑪ΪCa��ԭ�Ӻ�����20�����ӣ���4�����Ӳ㣬���������Ϊ2��8��8��2��ԭ�ӽṹʾ��ͼΪ ��
��
�ʴ�Ϊ�� ��
�� ��
��
��3��ͬ����������ҽ����Լ������ǽ�������ǿ��ͬ�������϶��½�������ǿ���ǽ����Լ���������Ԫ����K�Ľ�������ǿ��F�ķǽ�������ǿ��ϡ������Arԭ�������Ϊ�ȶ��ṹ����ѧ��������ã�
�ʴ�Ϊ��K��F��Ar��
��4��S��Clλ�����ڱ���ͬ���ڣ�ClԪ�طǽ����Խ�ǿ���ɸ����⻯����ȶ����жϣ����ʵ�״̬�����������ʣ����ܱȽϷǽ�����ǿ�������ʶ������������Ʒ�Ӧ��Ҳ�������ڱȽϷǽ����ԣ�
�ʴ�Ϊ��Cl��b��
��5������������ԭ�Ӱ뾶����Ԫ��ΪNa��ͬ������ԭ�Ӱ뾶��С��Ԫ��ΪCl�������γ�NaCl���������ӻ����
�ʴ�Ϊ�����ӣ�
��6����ΪSi����������ΪSiO2��Si��Oԭ��֮���γɹ��ۼ���
�ʴ�Ϊ��SiO2�����ۣ�
���� ���⿼��Ԫ�����ڱ���Ԫ�������ɣ�ע���������Ԫ�����ڱ��ṹ��ע�����ս����ԡ��ǽ�����ǿ���Ƚ�ʵ����ʵ���ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������





 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��
�� ��A��BΪ��ͬ��ԭ�ӻ�ԭ���ţ���Ϊͬ���칹�壬��Ϊϩ����˳���칹�����ƶ�һ�ȱ�ϩ��ͬ���칹�壨������״�ṹ���У�������
��A��BΪ��ͬ��ԭ�ӻ�ԭ���ţ���Ϊͬ���칹�壬��Ϊϩ����˳���칹�����ƶ�һ�ȱ�ϩ��ͬ���칹�壨������״�ṹ���У�������| A�� | 3�� | B�� | 4�� | C�� | 5�� | D�� | 6�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ��װ�� | 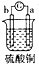 | 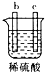 | 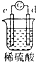 | 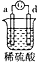 |
| ����ʵ������ | A��������С��b���������� | B�������������c���ޱ仯 | D���ܽ⣬c����������� | ������a������d�� |
| A�� | a��b��c��d | B�� | b��c��d��a | C�� | d��a��b��c | D�� | a��b��d��c |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2��g��+F2��g��=2HF��g����H=-Q1 kJ•mol-1 H2��g��+Cl2��g��=2HCl��g����H=-Q2 kJ•mol-1 | |
| B�� | 2H2��g��+O2��g��=2H2O��l����H=-Q1 kJ•mol-1 2H2��g��+O2��g��=2H2O��g����H=-Q2 kJ•mol-1 | |
| C�� | NaOH��aq��+HCl��aq��=NaCl��aq��+H2O��l����H=-Q1 kJ•mol-1 NaOH��aq��+CH3COOH��aq��=CH3COONa��aq��+H2O��l����H=-Q2 kJ•mol-1 | |
| D�� | S��s��+O2��g��=SO2��g����H=-Q1 kJ•mol-1 S��g��+O2��g��=SO2��g����H=-Q2 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | v��A��=0.5mol��L•min�� | B�� | v��B��=0.05 mol��L•s�� | ||
| C�� | v��C��=0.80 mol��L•min�� | D�� | v��D��=0.85 mol��L•min�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ѧ�� | H-H | H-F | H-Cl | H-Br |
| ����/kJ/mol | 436 | 565 | 431 | 368 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 һ��ͬѧ��4.48L��һ����ɱ�״���£�ij�л���������O2�г��ȼ�գ�Ȼ���ò�������ͨ��װ����ˮCuSO4�ĸ���ܡ�ʢ��Ũ�����ϴ��ƿ��ʢ�к�0.8mol Ca��OH��2�ij���ʯ��ˮ���ձ�����ͼ��ʾ��
һ��ͬѧ��4.48L��һ����ɱ�״���£�ij�л���������O2�г��ȼ�գ�Ȼ���ò�������ͨ��װ����ˮCuSO4�ĸ���ܡ�ʢ��Ũ�����ϴ��ƿ��ʢ�к�0.8mol Ca��OH��2�ij���ʯ��ˮ���ձ�����ͼ��ʾ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com