
| A�� | Y���⻯��ķе��R���⻯��ķе�� | |
| B�� | Z��W��R������������Ӧˮ���������ǿ������˳����R��W��Z | |
| C�� | X2Y2�������еĻ�ѧ����X2R�еĻ�ѧ��������ȫ��ͬ | |
| D�� | RY2ͨ��Ba��NO3��2��Һ���а�ɫ�������ɣ��ó������������� |
���� X��ԭ�Ӱ뾶�ڶ���������Ԫ�������ӦΪNaԪ�أ�YԪ�ص�ԭ������������Ϊm������������Ϊn��ZԪ�ص�ԭ��L�������Ϊm+n��M�������Ϊm-n����ΪL��������Ϊ8����n=2��m=6������YΪOԪ�أ�ZΪSiԪ�أ�WԪ����ZԪ��ͬ���壬ӦΪCԪ�أ�RԪ��ԭ����YԪ��ԭ�ӵĺ��������֮��Ϊ2��1��Y�ĺ��������Ϊ8����R�ĺ��������Ϊ16��ӦΪSԪ�أ����Ԫ�������ɿɽ����⣮
��� �⣺X��ԭ�Ӱ뾶�ڶ���������Ԫ�������ӦΪNaԪ�أ�YԪ�ص�ԭ����������Ϊm������������Ϊn��ZԪ�ص�ԭ��L�������Ϊm+n��M�������Ϊm-n����ΪL��������Ϊ8����n=2��m=6������YΪOԪ�أ�ZΪSiԪ�أ�WԪ����ZԪ��ͬ���壬ӦΪCԪ�أ�RԪ��ԭ����YԪ��ԭ�ӵĺ��������֮��Ϊ2��1��Y�ĺ��������Ϊ8����R�ĺ��������Ϊ16��ӦΪSԪ�أ�
A��Y���⻯����ˮ��R���⻯�������⣬ˮ���Ӽ���������ʹ�е����ߣ�ˮ�ڳ�������Һ�壬���������壬��ˮ�ķе���ߣ���A��ȷ��
B��R��SԪ�أ�W��CԪ�أ�ZΪSiԪ�أ�Ԫ�صķǽ�������������������������Ӧˮ�����������������B��ȷ��
C��X��Y�γɵ����ֻ�����ֱ�ΪNa2O��Na2O2�����߶������ӻ�����������Ӽ���Na2O2�л����й��ۼ���X2R��Na2S�������ӻ�������ֻ�������Ӽ������Ի�ѧ�������Ͳ���ȫ��ͬ����C����
D��SO2ͨ��Ba��NO3��2��Һ����������ԭ��Ӧ���а�ɫ�������ᱵ���ɣ��ó������������ᣬ��D��ȷ��
��ѡ��C��
���� ���⿼��ԭ�ӽṹ��Ԫ�������ɵĵݱ���ɣ���Ŀ�Ѷ��еȣ�����ԭ�ӽṹ�ص���ȷ�ƶ�Ԫ�ص�����Ϊ������Ĺؼ���ע��SO2ͨ��Ba��NO3��2��Һ����������ԭ��Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
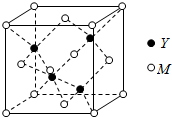 M�ǵ�������Ԫ�أ������ֻ��1�����ӣ�����������ԭ�ӹ�����������ӣ�Ԫ��Y�ĸ�һ�����ӵ��������������������ͬ���ش��������⣺
M�ǵ�������Ԫ�أ������ֻ��1�����ӣ�����������ԭ�ӹ�����������ӣ�Ԫ��Y�ĸ�һ�����ӵ��������������������ͬ���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
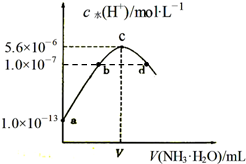 �����£���20mLijŨ�ȵ�������Һ�е���0.1mol•L-1��ˮ����Һ��ˮ�����������Ũ������백ˮ������仯��ͼ�����з�����ȷ���ǣ�������
�����£���20mLijŨ�ȵ�������Һ�е���0.1mol•L-1��ˮ����Һ��ˮ�����������Ũ������백ˮ������仯��ͼ�����з�����ȷ���ǣ�������| A�� | ��ͼ��֪ϡ�����Ũ��Ϊ0.1 mol•L-1 | |
| B�� | b����ҺpH=7 | |
| C�� | c����ʾ��Һ�У�c��SO42-����c��NH4+����c��H+����c��OH-�� | |
| D�� | d����ʾ��Һ�У�c��NH4+��=2c��SO42-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
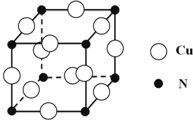 ��͵�Ԫ���ڻ�ѧ���к���Ҫ�ĵ�λ���ش��������⣺
��͵�Ԫ���ڻ�ѧ���к���Ҫ�ĵ�λ���ش��������⣺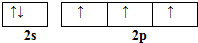 ��Ԥ����2017�귢��ġ��϶���š�̽�������õij���5�����ػ��ȼ��Ϊƫ������[��CH3��2NNH2]����CH3��2NNH2��Nԭ�ӵ��ӻ���ʽΪsp3��
��Ԥ����2017�귢��ġ��϶���š�̽�������õij���5�����ػ��ȼ��Ϊƫ������[��CH3��2NNH2]����CH3��2NNH2��Nԭ�ӵ��ӻ���ʽΪsp3��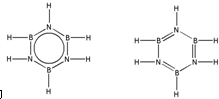 ����
�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �� 0.1 mol/L�İ�ˮ�м���������粒��壬����Һ��$\frac{c��O{H}^{-}��}{��N{H}_{3}•{H}_{2}O��}$���� | |
| B�� | �����£�0.1 mol/LһԪ�ᣨHA����Һ�� pH=3�������Һ�У�c2��H+��=c��H+����c��A-��+Kw | |
| C�� | ���� 1 mol KAl��SO4��2 ����Һ�м��� Ba��OH��2 ��Һ�õ����������ʵ������Ϊ 2 mol | |
| D�� | �� Ca��ClO��2��Na2SO3��FeCl3��NaAlO2 ��Һ���ɾ��ò���ԭ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
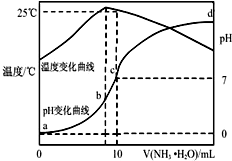 ��ij�¶�ʱ����nmol•L-1��ˮ����10mL1.0mol•L-1�����У���ҺpH���¶�����백ˮ����仯������ͼ��ʾ�������й�˵����ȷ���ǣ�������
��ij�¶�ʱ����nmol•L-1��ˮ����10mL1.0mol•L-1�����У���ҺpH���¶�����백ˮ����仯������ͼ��ʾ�������й�˵����ȷ���ǣ�������| A�� | a��Kw=1.0��10-14 | |
| B�� | 25��ʱNH4Clˮ�ⳣ��Ϊ����n-1����10-7mol•L-1����n��ʾ�� | |
| C�� | b�㣺c��NH4+����c��Cl-����c��H+����c��OH-�� | |
| D�� | ˮ�ĵ���̶ȣ�b��c��a��d |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
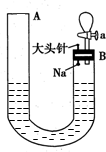 ��ͼ���й�����ˮ��Ӧ����������ʵ��װ�ã�ʵ�鿪ʼʱ������ڼ�����з�̪��ˮ��ʹˮλ�ﵽB�˹ܿڣ�Ȼ��Ѹ�������������ε���ͷ�룬��ʱNa����ˮ�У��ش��������⣺
��ͼ���й�����ˮ��Ӧ����������ʵ��װ�ã�ʵ�鿪ʼʱ������ڼ�����з�̪��ˮ��ʹˮλ�ﵽB�˹ܿڣ�Ȼ��Ѹ�������������ε���ͷ�룬��ʱNa����ˮ�У��ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1 mol/L NaHCO3��Һ��0.1 mol/L NaOH��Һ�������ϣ�������Һ�У�c��Na+����c��CO32-����c��HCO3-����c��OH-�� | |
| B�� | 20 mL 0.1 mol/L CH3COONa��Һ��10 mL 0.1 mol/L HCl��Һ��Ϻ���Һ�����ԣ�������Һ�У�c��CH3COO-����c��Cl-����c��CH3COOH����c��H+�� | |
| C�� | �����£�pH=2��������pH=12�İ�ˮ�������ϣ�������Һ�У�c��Cl-��+c��H+����c��NH4+��+c��OH-�� | |
| D�� | 0.1 mol/L CH3COOH��Һ��0.1 mol/L NaOH��Һ�������ϣ�������Һ�У�c��OH-����c��H+��+c��CH3COOH�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com