
分析 结合n=$\frac{V}{Vm}$=$\frac{N}{N{\;}_{A}}$=$\frac{m}{M}$计算结合物质分子的构成解答.
解答 解:①6.72L CH4气体,其物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,分子数为0.3NA;原子个数为:0.3NA×5=1.5NA;
②3.01×1023个HCl气体分子,其物质的量为$\frac{3.01×10{\;}^{23}}{6.02×10{\;}^{23}}$=0.5mol,分子数为0.5NA;原子个数为:0.5NA×2=1NA;
③13.6g H2S气体,其物质的量为$\frac{13.6g}{34g/mol}$=0.4mol;分子数为:0.4NA;原子个数为:0.4NA×3=1.2NA;
④0.2mol NH3,分子数为:0.2NA;原子个数为:0.2NA×4=0.8NA;
所以:①四种气体所含有的分子数:②③①④;
故答案为:②③①④;
②四种气体所含有的原子数:①③②④;
故答案为:①③②④.
点评 本题考查物质的量的计算,为高频考点,把握以物质的量为中心的基本计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源:2016-2017学年山东省德州市高二上10月月考化学试卷(解析版) 题型:选择题
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是( )
A.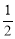 N2H4(g)+
N2H4(g)+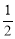 O2(g)=
O2(g)=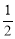 N2(g)+H2O(g) ΔH=+267 kJ·mol-1
N2(g)+H2O(g) ΔH=+267 kJ·mol-1
B.N2H4(g)+O2(g)==N2(g)+2H2O(g) ΔH =-534 kJ·mol-1
C.N2H4(g)+O2(g)==N2(g)+2H2O(g) ΔH =+534 kJ·mol-1
D.N2H4(g)+O2(g)==N2(g)+2H2O(l) ΔH =-133.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol苯分子中含有碳碳双键数为3NA | |
| B. | 标准状况下,22.4 L己烷中共价键数目为19NA | |
| C. | 14 g乙烯和丙烯的混合气体中所含原子总数为2NA | |
| D. | 常温下,0.1 mol乙烷与乙烯混合气体中所含碳原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
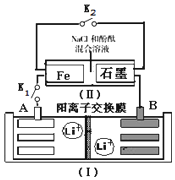 如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )
如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )| A. | 闭合K1,断开K2时,若将Fe电极和石墨电极互换,装置(Ⅱ)中发生的总反应为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ | |
| B. | 闭合K1,断开K2时,当0.1 mol Li+从A极区迁移到B极区,理论上Fe电极上产生的气体体积为1.12 L(标准状况下) | |
| C. | 取下锂离子电池充电,电极A为阳极,发生还氧化反应,电极上发生的电极反应式为:Li7Ti5O12-3e-═Li4Ti5O12+3 Li+ | |
| D. | 若开始时,断开K1,闭合K2,一段时间后,石墨电极附近显红色,则该电极反应为:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50 mL 0.2 mol•L-1 的 NaCl 溶液 | |
| B. | 100 mL 0.1 mol•L-1 的 NaCl 溶液 | |
| C. | 25 mL 0.2 mol•L-1 的 Na2SO4 溶液 | |
| D. | 10 mL 0.5mol•L-1 的 Na2CO3 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 物质的量为0.5 mol的MgCl2中,含有Mg2+个数为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气、硫酸铜、H2SO4 | B. | HCl、Fe(OH)3胶体、纯碱 | ||
| C. | 二氧化碳、胆矾、氢氧化钾 | D. | HNO3、食盐水、烧碱 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第一次月考化学试卷(解析版) 题型:选择题
1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为( )
A.C+H2O==CO+H2ΔH==+131.3KJ·mol—1
B.C(s)+H2O(g)==CO(g)+H2(g)ΔH==+10.94KJ·mol—1
C.C(s)+H2O(l)==CO(g)+H2(g)ΔH==+131.3KJ·mol—1
D.C(s)+H2O(g)==CO(g)+H2(g)ΔH==+131.3KJ·mol—1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com