
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下:
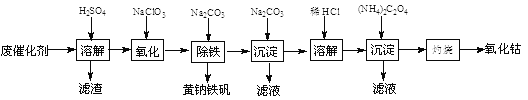
(1)溶解:溶解后过滤,将滤渣洗涤2~3次,滤渣的主要成分是________。(填化学式)
(2)氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式是________________。
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]·3H2O。
3Fe2++ 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++ 3[Fe(CN)6 ]4- = Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是__________________________________________。(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式:______________________________________。
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2·3Co(OH)2],沉淀需洗涤,洗涤的操作是_______________________。
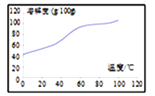
(5)溶解:CoCl2的溶解度曲线如图所示。向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是___________________________。
(6)三氧化铁是一种重要的化合物,可以用来腐蚀电路板。常温下,某腐蚀废液中含有0.5 molL-1 Fe3+ 和0.26 molL-1 Cu2+,欲使Fe3+完全沉淀[c(Fe3+)<4×10-5 molL-1时完全沉淀]而Cu2+不沉淀,则需控制溶液 pH的范围为_________________。 {KspCu(OH)2]=2.6×10-19 ;KspFe(OH)3]=4×10-38}
【答案】 SiO2 6Fe2++6H++C1O3-![]() 6Fe3++C1-+3H2O 取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则Fe2+已全部被氧化 3Fe2(SO4)3+6H2O+6N a2CO3=Na2Fe6(SO4)4(OH)12↓+5Na2SO4+ 6CO2↑ 沿玻璃棒向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出。重复操作2~3 次 防止因温度降低,CoCl2晶体析出 3≤pH<5
6Fe3++C1-+3H2O 取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则Fe2+已全部被氧化 3Fe2(SO4)3+6H2O+6N a2CO3=Na2Fe6(SO4)4(OH)12↓+5Na2SO4+ 6CO2↑ 沿玻璃棒向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出。重复操作2~3 次 防止因温度降低,CoCl2晶体析出 3≤pH<5
【解析】含钴废催化剂加入稀硫酸,发生Co+H2SO4=CoSO4+H2↑,Fe+H2SO4=FeSO4+H2↑,过滤滤渣是不溶的二氧化硅,而滤液是硫酸钴、硫酸亚铁与过量的硫酸的混合溶液,向滤液中加氯酸钠将亚铁离子氧化成铁离子,然后加入碳酸钠得到黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,继续向滤液中加入碳酸钠,得到碱式碳酸钴[(CoCO3)23Co(OH)2],然后用盐酸溶解碱式碳酸钴[(CoCO3)23Co(OH)2],再向所到溶液中加入草酸铵,得到溶解度极小的草酸钴,最后灼烧生成氧化钴。
(1)根据上述分析,溶解后过滤,将滤渣洗涤2~3次,滤渣的主要成分是SiO2,故答案为:SiO2;
(2)亚铁离子被氯酸根离子氧化成铁离子,1molr的亚铁离子失去1mol的电子,而1mol的氯酸根离子得到6mol的电子,根据电子得失守恒,可知离子方程式为:6Fe2++6H++ClO3-═6Fe3++Cl-+3H2O,取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则Fe2+已全部被氧化,故答案为:6Fe2++6H++ClO3-![]() 6Fe3++Cl-+3H2O;取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则Fe2+已全部被氧化;
6Fe3++Cl-+3H2O;取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则Fe2+已全部被氧化;
(3)生成硫酸铁与碳酸钠发生双水解得到黄钠铁矾,化学反应方程式为:3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6(SO4)4(OH)12↓+5Na2SO4+6CO2↑,故答案为:3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6(SO4)4(OH)12↓+5Na2SO4+6CO2↑;
(4)沉淀洗涤的方法是向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次,故答案为:向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次;
(5)CoCl2的溶解度曲线可知,随温度的升高,CoCl2的溶解度增大,所以趁热过滤,防止温度降低氯化钴析出,故答案为:防止因温度降低,CoCl2晶体析出;
(6)Fe3+完全沉淀时c(OH-)3=![]() =
=![]() (mol/L)3=1×10-33 (mol/L)3,此时c(OH-)=10-11 mol/L,pH=3;Cu2+沉淀时c(OH-)2=
(mol/L)3=1×10-33 (mol/L)3,此时c(OH-)=10-11 mol/L,pH=3;Cu2+沉淀时c(OH-)2=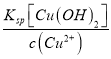 (mol/L)2=
(mol/L)2=![]() (mol/L)2=1×10-18 (mol/L)2,c(OH-)=10-9 mol/L,pH=5,所以控制溶液的pH范围为3≤pH<5,故答案为:3≤pH<5;
(mol/L)2=1×10-18 (mol/L)2,c(OH-)=10-9 mol/L,pH=5,所以控制溶液的pH范围为3≤pH<5,故答案为:3≤pH<5;


科目:高中化学 来源: 题型:
【题目】镁、硫、氮的化合物在工业上用途非常广泛。
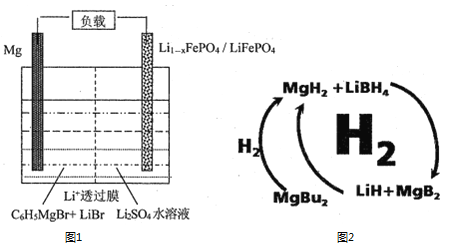
(1)一种镁—锂双离子二次电池的装置如图1所示。
①放电时,Mg电极为_____(填“正极”或“负极”)。
②充电时,Li+迁移至_____________(填“阳极区”或“阴极区”)。
(2)纳米MgH2和LiBH4组成的体系如图2所示,400℃以上受热放氢时发生反应的化学方程式为_____________________________________________。
(3)硝酸厂尾气中含有大量的NO,可用氢气催化还原法除去NO,发生的主要反应如下:
2NO(g)+4H2(g)+O2(g)==N2(g)+4H2O(g) △H =-1143kJ·mol-1
2H2(g)+ O2(g)==2H2O(g) △H =-484kJ·mol-1
则2NO(g)+2H2(g)==N2(g)+2H2O(g) △H =____kJ·mol-1
(4)在一定条件下,反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图3所示。
2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图3所示。
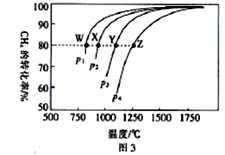
①图中p1、p2、p3、p4代表不同压强,压强最大的是_______。该反应的△H___(填“>”“<”“=”下同)0。
②压强为p4时,在Y点:v(正)__________v(逆)。
③图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、K3、K4由大到小的顺序为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生产生活中,我们会遇到各种各样的化学反应。下列反应属于氧化还原反应的是
A. 用天然气(主要成分为CH4)逐步代替煤气作为燃料
B. 用无水硫酸铜(CuSO4)检验工业酒精中是否含有少量的水
C. 将生石灰(CaO)投入水中,即可得到建筑用的熟石灰[Ca(OH)2]
D. 碳铵(NH4HCO3)是一种常用的化肥,应保存于阴凉处,因为在较高温度下,它会分解生成氨气、水和二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组设计下图装置制备氯气,图中涉及气体发生、除杂、干燥、收集及尾气处理装置。
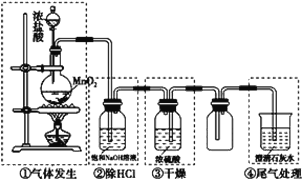
(1)上述装置中,错误的是____________(选填字母)。
A.①②④ B.①②③ C.①③④ D.②③④
(2)写出装置①中发生反应的化学方程式_____________________________________。该反应中,氧化剂是__________________。
(3)使0.15mol MnO2 与过量的12mol/L的浓盐酸反应,使50mL 12mol/L的浓盐酸与足量MnO2反应,两者产生的氯气相比(其他条件相同)____________(选填字母)。
A.一样多 B.前者较后者多
C.后者较前者多 D.无法比较
(4)将新制氯水滴到pH试纸上,有何现象?_________________________________。
(5)工业上用氯气生产漂白粉的化学反应方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把18.0mol/L的浓硫酸稀释成1.2mol/L的稀硫酸250mL。
(1)1.2mol/L的稀硫酸的含义是__________(选填字母)。
A.1L水中含有1.2mol H2SO4
B.1L溶液中含有1.2mol H+
C.将117.6g硫酸溶于1L水所配成的溶液
D.从100mL该溶液中取出10mL,剩余溶液的物质的量浓度仍为1.2mol/L
(2)请在下列操作步骤中填写有关的空格:
①用量筒量取_________mL的18.0mol/L的浓硫酸;
②将_______________沿烧杯内壁慢慢注入盛有少量____________的烧杯中;
③将已冷却至室温的硫酸溶液沿玻璃棒注入_________mL的容量瓶中;
④用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
⑤继续向容量瓶中加蒸馏水,直至液面接近刻度线1~2cm处;
⑥改用___________________逐滴加蒸馏水,使溶液凹液面恰好与刻度线相切;
⑦盖好容量瓶塞,反复颠倒,摇匀;
⑧将配好的稀硫酸倒入试剂瓶中,贴好标签。
(3)由于操作不当,会引起实验误差。下列情况对所配制的H2SO4溶液的物质的量浓度有何影响?(用“偏高”、“偏低”、“无影响”填空)。
①容量瓶用蒸馏水洗涤后残留有少量的水_____________;
②定容时,某同学观察液面的情况如图所示_____________;

③摇匀后,发现溶液的液面低于刻度线,又加水至刻度线____________。
(4)某同学取配制的1.2mol/L的稀硫酸100mL,向其中加入足量的锌粒,产生的H2在标准状况下的体积为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子能大量共存的是( )
A. 稀硫酸中:K+、Mg2+、A1O2-、S2O32-
B. KW/c(H+)=10-13 mol·L-1 的溶液中:Fe3+、NH4+、Mg2+、SO42-
C. 使甲基橙变红的溶液中:Fe2+、MnO4﹣、Na+、SO42﹣
D. 通入大量 CO2 的溶液中:Na+、ClO-、CH3COO-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述不正确的是( )
A. 足量锌与一定量浓H2SO4反应生成0.5mol气体,反应中转移的电子数为NA
B. 1L 0.1mol/L的CH3COOH溶液中含有H+的数目约为0.1 NA
C. 电解精炼铜(粗铜中含有锌、铁、银等杂质),电路中有2NA个电子通过时,阴极增重64g
D. 常温常压下,1.8 g甲基(-CD3)中含有的电子数为0.9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气, 放出256.64kJ的热量。
(1)写出该反应的热化学方程式
(2)已知H2O (l) = H2O(g) △H= + 44 kJ·mol-1,则16g液态肼燃烧生成氮气和液态水时,放出的量是 kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的 优点
(4)已知N2(g)+2O2(g)=2 NO2(g) △H= +68 kJ·mol-1, N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com