
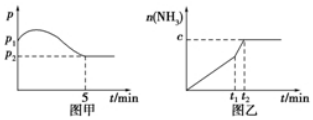
分析 (1)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,据此解答,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)根据三段法建立关系,利用压强之比等于物质的量之比去求出氨气的物质的量,然后根据外界条件对速率和平衡的影响来判断平衡移动方向;根据温度对化学平衡常数的影响来分析;
(3)由(2)根据转化率=$\frac{转化量}{起始量}$×100%和v(N2)=$\frac{△c}{△t}$计算即可;
解答 解:(1)A.反应前后气体的物质的量不变,温度一定,容器中压强始终不变,故压强不变,不能说明到达平衡状态,故A错误;
B.反应达到平衡状态时,各物质的浓度不变,混合气体中c(CO)不变说明到达平衡状态,故B正确;
C.v (H2)正=v (H2O)逆,不同物质表示的速率之比等于化学计量数之比,说明到达平衡状态,故C正确;
D.平衡时二氧化碳与一氧化碳的浓度与转化率有关,c(CO2)=c(CO)不能说明到达平衡,故D错误;
故答案为;BC;
(2)3H2(g)+N2(g)?2NH3(g),
投料 3mol 1 mol 0
转化量 3x x 2x
平衡量 3-3x 1-x 2x
反应前后的压强比等于物质的量比即(4-2x):4=0.6,x=0.8,n(NH3)=1.6 mol,
①若图中n(NH3)=1.6mol,则平衡没移动,但速率加快,所以改变的条件是使用催化剂,故选:E;
②若图中n(NH3)<1.6mol,则平衡逆向移动,且速率加快,只能升高温度;该反应正反应为放热反应,升高温度平衡向吸热的方向移动,即逆向移动,所以平衡常数减小,
故答案为:E;A;减小;
(3)3H2(g)+N2(g)?2NH3(g),
投料 3mol 1 mol 0
转化量 3x x 2x
平衡量 3-3x 1-x 2x
反应前后的压强比等于物质的量比即(4-2x):4=0.6,x=0.8,所以平衡时氢气的转化率=$\frac{转化量}{起始量}$×100%=$\frac{2.4mol}{3mol}$×100%=80%,v(N2)=$\frac{△c}{△t}$=$\frac{\frac{0.8}{2}}{5}$=0.08mol/(L•min),故答案为:80%;0.08mol/(L•min).
点评 本题借助于图象考查了化学反应速率、化学平衡的标志、化学平衡计算,化学平衡的影响因素等,题目难度中等,注意反应原理的掌握.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙酸具有酸的通性,能使紫色的石蕊溶液变红 | |
| B. | 在一定条件下,苯与液溴、浓硝酸作用生成溴苯、硝基苯的反应都属于取代反应 | |
| C. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| D. | 用溴水可以鉴别乙烯和乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强碱性溶液中:K+、Mg2+、Cl-、SO42- | |
| B. | 滴加石蕊试液显红色的溶液::K+、Al3+、Cl-、NO3- | |
| C. | 含有0.1mol•L-1Ca2+的溶液中:Na+、K+、CO32-、Cl- | |
| D. | 无色透明的酸性溶液中:MnO4-、K+、SO42-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:200 | B. | 200:1 | C. | 100:1 | D. | 1:100 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把浑浊的液体倒入蒸发皿内加热 | |
| B. | 开始析出晶体后用玻璃棒搅拌 | |
| C. | 加入试剂的顺序为Na2CO3、BaCl2、NaOH、HCl | |
| D. | 用过滤法除去粗盐中的泥沙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃烧热是101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量 | |
| B. | 工业上用点燃H2、Cl2混合气体的方法生产盐酸 | |
| C. | 金属钠着火时可用干燥的沙土来灭火 | |
| D. | 驰名世界的中国瓷器是硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com