
【题目】某市售照明材料LED晶片是一种发光二极管。材质组成为:GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、GaInN(氮化镓铟)等。请回答下列问题:
(1)砷基态原子的核外电子排布式为______________________。
(2)上述非金属元素氢化物的沸点从高到低的顺序为___________。
(3)下列说法正确的是___________
a.电负性:As<Ga b.SiC与GaAs互为等电子体 c.第一电离能:As>Se>Ga
(4)如图所示为GaAs的晶胞结构,晶体熔点为1237℃。
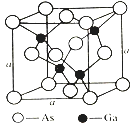
①晶胞中砷与镓原子间的化学键类型有___________。
②一个镓原子周围所有距离最近且相等的砷原子形成的空间构型是___________。
③一个晶胞的组成为___________。
④已知晶胞棱长a=5.64×10-10m,则该晶胞密度为ρ=___________。
【答案】 1s22s22p63s23p63d104s24p3 NH3>AsH3>PH3 bc 共价键(或极性键)、配位键 正四面体 Ga4As4 5.37g·cm-3
【解析】(1). 砷是33号元素,基态原子的核外电子排布式为1s22s22p63s23p63d104s24p3,故答案为:1s22s22p63s23p63d104s24p3;
(2). 因氨气分子之间存在氢键,所以氨气在三种氢化物中沸点最高,AsH3和PH3的组成和结构相似,相对分子质量越大,分子间作用力越大,氢化物的沸点越高,所以氢化物的沸点从高到低的顺序为:NH3>AsH3>PH3,故答案为:NH3>AsH3>PH3;
(3). a. 同一周期的元素,随原子序数增大,元素的电负性增大,所以电负性As>Ga,故a错误;b. SiC与GaAs中原子总数相等,价电子数相同,所以互为等电子体,故b正确;c. 同一周期的元素,随原子序数增大,元素的第一电离能呈增大趋势,As元素的价电子排布式为4s24p3,是一种半充满的稳定结构,第一电离能较大,所以第一电离能:As>Se>Ga,故c正确;答案为:bc;
(4). ①. 由GaAs的晶胞结构和晶体熔点可知,晶胞中砷与镓原子之间含有共价键,由于Ga原子最外层只有3个电子,而每个Ga原子与 4个As原子成键,因此其中一个键是配位键,故答案为:共价键(或极性键)、配位键;
②. 由晶胞结构可知,每个Ga原子与 4个As原子成键,一个Ga原子周围所有距离最近且相等的4个As原子构成正四面体,故答案为:正四面体;
③. Ga原子位于体内,个数为4,As原子位于顶点和面心,个数为8×![]() +6×
+6×![]() =4,所以一个晶胞的组成为Ga4As4,故答案为:Ga4As4;
=4,所以一个晶胞的组成为Ga4As4,故答案为:Ga4As4;
④. 由上述分析可知,一个晶胞的组成为Ga4As4,则该晶胞的密度为ρ=![]() =5.37g·cm-3,故答案为:5.37g·cm-3。
=5.37g·cm-3,故答案为:5.37g·cm-3。


 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该工业废水中回收硫酸亚铁和金属铜。请根据流程图,回答下列问题。

(1)写出对应物质的化学式:①为________________________,②为_____________________________,A中含有的物质____________________。
(2)操作②的名称为__________________。
(3)母液中含有的离子主要有(填离子符号):__________________。
(4)操作③包括_______________________________和过滤,再经洗涤、干燥操作可以得到纯净的FeSO47H2O晶体,。
(5)在上述流程中,涉及到的离子方程式有______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以苯为主要原料,采用以下路线合成医药中间体G和可降解聚合物C。

已知:![]()
(1)写出X的结构式_______________________________。
(2)对于高分子化合物C的说法正确的是_____________(填序号)。
A.1molC能与2n mol NaOH反应
B.(C9H8O3)n即是高分子化合物C的化学式,也是链节的化学式
C.高分子化合物C是缩聚产物
D.酸性条件下降解时有气泡产生
(3)在一定条件下,E可以生成一种含有3个六元环的化合物(C18H16O4),请写出该反应的化学方程式___________________________________。
(4)写出符合要求的G的同分异构体(含有![]() 的有机物不能稳定存在)________。
的有机物不能稳定存在)________。
a.遇FeCl3溶液显紫色; b.能与Br2按1︰2发生加成反应; c.苯环上只有两种等效氢
(5)根据题目所给信息,以F和乙烯为原料,设计合成G的反应路线(用流程图表示,无机试剂任选)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的分离与提纯是化学的重点,根据下列实验目的,分别选择相应的实验装置。

(1)除去氯化钠晶体中的碳酸钠______。
(2)除去碳酸钙中的氯化钠______。
(3)分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合液(两者互溶):______。
(4)从溴水中提取溴______。
(5)除去氧化钙中的碳酸钙______。
(6)分离固体食盐和碘的方法______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的叙述中正确的是
A.在元素周期表中共有18个纵列,18个族B.稀有气体元素原子最外层电子数均为8
C.副族元素全部是金属元素D.碱金属元素是指ⅠA族的所有元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在无色碱性溶液中能大量共存的是( )
A.Na+、H+、MnO4﹣、SO42﹣
B.Na+、K+、NO3﹣、SO42﹣
C.Fe2+、Cl﹣、CO32﹣、SiO32﹣
D.Mg2+、Na+、Cl﹣、HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO+H2的混合气体又称“合成气”,在合成有机物中应用广泛。工业上常采用天然气与水蒸气或二氧化碳反应等方法来制取合成气。请回答下列问题:
(1)已知在一定条件下,0.25molCH4 与水蒸气完全反应制备“合成气”时吸收51.5kJ 的热量,请写出该反应的热化学方程式__________________________________________________。
(2)天然气与CO2反应也可制备合成气,在10L 密闭容器中通入lmolCH4 与1molCO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示。

①1100℃、P2时气体混合后反应经过10min 至x 点的平衡,用CO 的变化量表示反应速率v(CO)=_____________;
②下列选项中能表示该反应已达到平衡状态的是____________;
A.v(H2)逆=3v (CO)正 B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变 D.c(CH4)=c(CO)
③由图1可知,压强P1_______P2 (填“大于”或“小于”);压强为P2时,在y点: v(正)____ v(逆) (填“大于”“小于”或“等于”)。求y点对应温度下的该反应的平衡常数K= __________。
(3)天然气中的H2S 杂质常用氨水吸收,产物为NH4HS。
已知: 25℃时,NH3·H2O 的电离常数K=1.8×10-5,H2S 的两步电离常数分别为Ka1=1.3×10-7,Ka2=7.1×10-15。求NH4HS溶液中离子浓度大小关系_____________________(由大到小)。
(4)合成气制甲醚的反应方程式为2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) △H= b kJ/mol。有研究者在催化剂、压强为5.0MPa 的条件下,由H2和CO 直接制备甲醚,结果如图2 所示。
CH3OCH3(g)+H2O(g) △H= b kJ/mol。有研究者在催化剂、压强为5.0MPa 的条件下,由H2和CO 直接制备甲醚,结果如图2 所示。

①290℃前,CO转化率和甲醚产率的变化趋势不一致的原因是___________________________;
②b______0 (填“ >”或“<”或“=”) ,理由是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】诺贝尔生理学和医学奖的最大一次失误是1948年授予了瑞士化学家米勒,由于米勒发明了剧毒有机氯杀虫剂DDT而获得当年诺贝尔奖。DDT的结构简式为![]() ,由于DDT是难降解的化合物,毒性残留时间长,世界各国现已明令禁止生产和使用。下列关于DDT的说法中正确的是
,由于DDT是难降解的化合物,毒性残留时间长,世界各国现已明令禁止生产和使用。下列关于DDT的说法中正确的是
A. DDT分子中两苯环不可能共平面 B. DDT属于芳香烃
C. DDT分子可以发生消去反应 D. DDT难以降解的原因是不能发生水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com