
(12分). A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上非金属元素中所形成的最简单气态氢化物稳定性最弱的是(填化学式) ;E、F、L、I所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
(2)由L、I两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为 。固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式 。
(3)在10 L的密闭容器中,通入2 mol LD2气体和1 mol D2气体,一定温度下反应后生成LD3气体,当反应达到平衡时,D2的浓度为0.01 mol·L-1,同时放出约177 KJ的热量,则平衡时LD2的转化率为 ;该反应的热化学方程式为: 。
(12分). (每空2分)
(1) SiH4 , S2->Cl->Na+>Al3+ ;
(2) 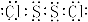 , Na2O2 + Na2S + 2H2O = S + 4Na++4OH- ;
, Na2O2 + Na2S + 2H2O = S + 4Na++4OH- ;
(3) 90% , 2SO2(g)+ O2(g)= 2SO3(g) △H = - 196.7 KJ/mol 。
【解析】
试题分析:(1)B、C、D为同一周期,且原子序数处于9种元素的中间,所以三种元素是第二周期元素,A是第一周期元素,所以A是H元素;E、F、G、L、I是第三周期元素,A与E同主族,则E是Na元素;C和D的最外层电子数之和是11,第二周期元素中最外层电子数之和是11的元素可能是C与F或N与O,若为C与F元素,F的质子数比D多5,则F是Si,C、D、F三种元素的原子序数之和为29,与题意不符,所以C是N元素,D是O元素,则F是Al元素,B与G、D与L分别为同一主族,则B是C元素,G是Si元素,L是S元素,所以I是Cl元素。
(1)以上非金属元素中所形成的最简单气态氢化物稳定性最弱的也即非金属性最弱的是Si,对应的氢化物的化学式为SiH4;E、F、L、I所形成的简单离子中,E、F的离子的核外有2个电子层,而L、I的离子核外有3个电子层,半径随电子层数增多而增大,随核电荷数增多而减小,所以四种离子的半径由大到小的顺序为S2->Cl->Na+>Al3+;
(2)S与Cl形成的原子个数比1:1的化合物X,化合物X中各原子均满足8电子的稳定结构,所以X的化学式为S2Cl2,电子式为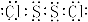 ;固体化合物E2D2投入到化合物E2L的水溶液中,即过氧化钠与硫化钠的反应,过氧化钠与水反应生成氢氧化钠与氧气,氧气与硫化钠溶液发生氧化还原反应生成的沉淀是S单质和氢氧化钠,所以离子方程式为Na2O2 + Na2S + 2H2O = S + 4Na++4OH-;
;固体化合物E2D2投入到化合物E2L的水溶液中,即过氧化钠与硫化钠的反应,过氧化钠与水反应生成氢氧化钠与氧气,氧气与硫化钠溶液发生氧化还原反应生成的沉淀是S单质和氢氧化钠,所以离子方程式为Na2O2 + Na2S + 2H2O = S + 4Na++4OH-;
(3)二氧化硫与氧气反应生成三氧化硫,由题意可知,二氧化硫的起始浓度是0.2mol/L,氧气的起始浓度是0.1mol/L,平衡时氧气的浓度是0.01 mol·L-1,则平衡时二氧化硫的浓度是0.02 mol·L-1,所以二氧化硫的转化率是(0.2-0.02) mol·L-1/0.2mol/L=90%;2mol的二氧化硫转化1.8mol时放出177kJ的热量,则2mol二氧化硫完全转化时放出的热量是177kJ/0.9=196.7kJ,所以该反应的热化学方程式为2SO2(g)+ O2(g)= 2SO3(g) △H = - 196.7 KJ/mol
考点:考查元素的推断,元素及其化合物的性质,电子式的书写,方程式的书写,转化率的计算等


科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:填空题
已知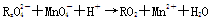 变化过程中,0.2 mol
变化过程中,0.2 mol 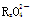 参加反应,共转移0.4 mol 电子。
参加反应,共转移0.4 mol 电子。
(1)反应的氧化产物为 。
(2)x=________。
(3)参加反应的氢离子的物质的量为________。
(4)配平题中的离子方程式并将配平后的式子写在下面横线上
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期回头考试化学试卷(解析版) 题型:填空题
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
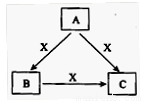
①A中所含有的化学键是_____________, X属于的晶体类型是_________。
②将4.48 L(标准状况下)X通入100mL 3 mol/L A的水溶液后,溶液中发生的离子反应方程式为______。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为______ g
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期回头考试化学试卷(解析版) 题型:选择题
通过复习总结,下列归纳正确的是 ( )
A.Na2O,NaOH,Na2CO3,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物
B.简单非金属阴离子只有还原性,而金属阳离子不一定只有氧化性
C.一种元素可能有多种氧化物,但同种化合价只对应有一种氧化物
D.物质发生化学变化一定有化学键断裂与生成,并伴有能量变化,而发生物理变化就一定没有化学键断裂或生成
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期回头考试化学试卷(解析版) 题型:选择题
下列变化不能说明发生了化学变化的是( )
A.变化时有电子的得失或共用电子对的偏移
B.变化过程中有旧化学键的断裂和新化学键的形成
C.变化时释放出能量
D.变化前后原子的种类和数目没有改变,分子种类增加了
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三第一次联考化学试卷(解析版) 题型:选择题
X、Y、Z是三种常见元素的单质,甲乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是
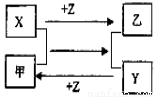
A.X、Y、Z都是非金属单质
B.X、Y、Z中至少有一种是金属单质
C.如果X、Y都为非金属单质,则Z必为金属单质
D.如果X、Y都为金属单质,则Z必为非金属单质
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三第一次联考化学试卷(解析版) 题型:选择题
氯化溴(BrCl)化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和非金属反应生成相应的卤化物,跟水反应的化学方程式为BrCl+ H2O = HCl+ HBrO关于BrCl叙述错误的是:( )
A.固态溴化碘是由极性键构成的分子晶体 B. 和NaOH溶液反应生成NaCl和NaBrO
C.能使湿润的淀粉碘化钾试纸变蓝 D.与水反应时BrCl既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三上学期期中联考化学试卷(解析版) 题型:选择题
利用右图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是
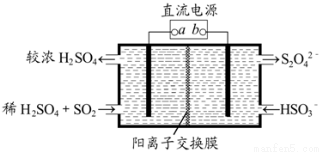
A.a为直流电源的负极
B.阴极的电极反应式为:2HSO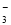 +2H++e-===S2O
+2H++e-===S2O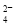 +2H2O
+2H2O
C.阳极的电极反应式为:SO2+2H2O-2e-===SO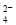 +4H+
+4H+
D.电解时,H+由阴极室通过阳离子交换膜到阳极室
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三月考(10月)化学试卷(解析版) 题型:填空题
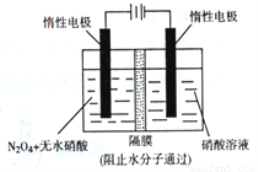
(6分)随着大气污染的日趋严重,国家拟于“十二五”期间,将氮氧化物(NOx)排放量减少10%,回答 下列与氮化合物相关的问题。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 。
(2)肼(N2H4)用亚硝酸氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977。写出肼与亚硝酸反应的化学方程式 。
(3)如图所示装置可用于制备N2O5,则生成N2O5的那一极电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com