
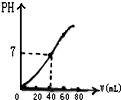
 用1.0mol?L-1NaOH溶液中和某浓度H2SO4溶液,其PH和所用NaOH溶液的体积关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
用1.0mol?L-1NaOH溶液中和某浓度H2SO4溶液,其PH和所用NaOH溶液的体积关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )| A、1.0mol?L-1、60mL |
| B、0.5mol?L-1、80mL |
| C、0.5mol?L-1、40mL |
| D、1.0mol?L-1、80mL |
| 1 |
| 2 |
| 2×0.5mol/L×0.04L |
| 1mol/L |


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
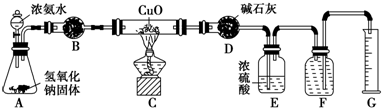 氨气与灼热的氧化铜反应生成铜、氮气和水.利用如图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去).回答下列问题:
氨气与灼热的氧化铜反应生成铜、氮气和水.利用如图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、③④①② |
| C、④①③② | D、②①④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
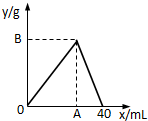 如图是表示往50mL AlCl3溶液中滴加4mol?L-1的NaOH溶液,生成沉淀的质量(y轴)与消耗NaOH溶液的体积(x轴)的关系.填空:
如图是表示往50mL AlCl3溶液中滴加4mol?L-1的NaOH溶液,生成沉淀的质量(y轴)与消耗NaOH溶液的体积(x轴)的关系.填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(H2)=0.3 mol?L-1?min-1 |
| B、v(N2)=0.2 mol?L-1?min-1 |
| C、v(NH3)=0.25 mol?L-1?min-1 |
| D、v(H2)=0.4 mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、常温下,NO分解产生O2的反应的平衡常数表达式为K1=
| ||
| B、常温下,水分解产生O2,此时平衡常数的数值约为5×10-80 | ||
| C、常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2 | ||
D、反应2CO(g)+2NO(g)=N2(g)+2CO2(g)的平衡常数K4=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
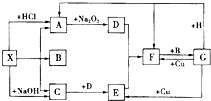 如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B是液体,G是一种溶液,其余均为气体,1mol X分解得到A、B、C各1mol.
如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B是液体,G是一种溶液,其余均为气体,1mol X分解得到A、B、C各1mol.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na→Na2O2 |
| B、Si→H2SiO3 |
| C、CuSO4→CuCl2 |
| D、Cu(OH)2→CuO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com