
����Ŀ����ѧ�Ƽ������߶Ժ���̼���ʵĽ������ĸ�ʴ����Һ����ԵĹ�ϵ�������о�����25��ʱ�ó���ҺpHֵ�����ĸ�ʴӰ���ϵ��ͼ��ʾ,����˵����ȷ���ǣ� ��
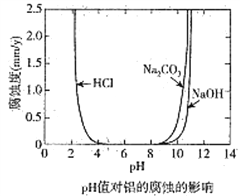
A. ��������Ũ�����еĸ�ʴ���ʴ��������еĸ�ʴ����
B. �����������Ի����в��ױ���ʴ
C. ��������pH=8.5��Na2CO3��Һ�лᷢ���绯ѧ��ʴ��������
D. �����õ��ķ����ڽ������ı����������ܵ������ﱡĤ
���𰸡�B
��������A����������Ũ�����в����ۻ�����ʴ����С�������еĸ�ʴ���ʣ���A����B����ͼ�п�֪����pH��4��8�������£��������������Ի����в��ױ���ʴ����B��ȷ��C�� ��������pH=8.5��Na2CO3��Һ�лᷢ���绯ѧ��ʴ������������ʧ���ӣ������������ϵõ��ӣ�������������C����D�����ص�������������ʱ����õ缫��Ӧ��������ʧ���ӵĹ��̣���2Al+3H2O-6e����Al2O3+6H�����������������ӵĵõ��ӹ��̣�������Һ�У�Ϊ6H��+6e����3H2�������õ��ķ����ڽ������ı����������ܵ������ﱡĤ����D����ѡB��


 ���ʿ��ÿ��ֳɳ�ϵ�д�
���ʿ��ÿ��ֳɳ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ͬ��ѧԪ������ɵĻ��������˵������ȷ���ǣ� ��
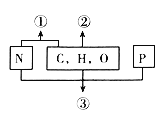
A. ������ij�ִ���ӵĻ�����ɵ�λ�������ǰ�����
B. ���������������Ҫ��Դ���ʣ�����������
C. ������ϸ���еĴ������ʣ�����һ����֬��
D. ������Я���Ŵ���Ϣ�Ĵ�������ʣ�����һ���Ǻ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���衢��ͭ�����ĵ��ʼ����������ִ���ҵ���������Ź㷺Ӧ�á��ش��������⣺
��1����̬Cu+�ĺ���۲�����Ų�ʽΪ_______________��Be��B��Al�ĵ�һ�������ɴ�С��˳����______________________________��
��2���������������Ԫ���γ���̬�⻯�����Si-H���й��õ��Ӷ�ƫ����Ԫ�أ�����������Ӧʱ�����������������������ĵ縺����Դ�СΪSe___ Si(�>������<��)��
��3��SeO32-��Seԭ�ӵ��ӻ�����Ϊ______�����以Ϊ�ȵ������һ�ַ��ӵķ���ʽ��______________��
��4��CuSO4��Cu(NO3)2����Ȼ������Ҫ��ͭ�Σ���CuSO4��Һ�м������ϡ��ˮ�������������ӵĿռ乹��Ϊ_________��Cu(NO3)2�еĻ�ѧ�����˦Ҽ��⣬������_______________��
��5������(BP)��һ����ĥ���ϣ��۵�ߣ��侧���ṹ��ͼ��ʾ���þ�����B�Ķѻ���ʽΪ___________����֪�þ���ľ�������a pm����NA���������ӵ�������ֵ����þ�����ܶ�Ϊ____ g��cm-3�����ɾ������������֮����������Ϊ__________pm��
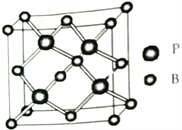
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��Ԫ�����ʵݱ����ʵ��ʱ�������һ��ʵ�鷽������¼���й�ʵ������
ʵ�鲽�� | ʵ������ |
�� ��þ����ɰֽ��ĥ�����Թ��У���������ˮ������ˮ���ڣ�������Һ�еμӷ�̪��Һ | A������ˮ���ϣ��۳�С���Ĵ��ζ���������˻˻��������֮��ʧ����Һ��ɺ�ɫ |
�ڽ�һС������Ʒ�����з�̪��Һ����ˮ�� | B���������������Һ���dz��ɫ |
�۽�þ��Ͷ��ϡ������ | C����Ӧ��ʮ�־��ң�������ɫ���� |
�ܽ�����Ͷ��ϡ������ | D�����ҷ�Ӧ��Ѹ�ٲ���������ɫ���� |
�������ͬѧ���������ʵ�鱨�档
��1��ʵ��Ŀ�ģ��о�_________________Ԫ�����ʵݱ���ɡ�
��2��ʵ�����ݣ�����д��ʵ�鲽���Ӧ��ʵ������ı�ţ�
ʵ������ | �� | �� | �� | �� |
ʵ��������A~D�� | _________ | ______ | _______ | ___________ |
��3��д��ʵ���\�ڶ�Ӧ��ѧ����ʽ
ʵ��� ______________________________________________________________________��
ʵ���_______________________________________________________________________��
��4��ʵ����ۣ�______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(˫ѡ)��ͼ��ʾ�Ǿ���ṹ�о��д����Ե���С�ظ���Ԫ(����)�����з�ʽ�����Ӧ�Ļ�ѧʽ��ȷ����(ͼ�У�![]() ��X��
��X��![]() ��Y������Z)(����)
��Y������Z)(����)
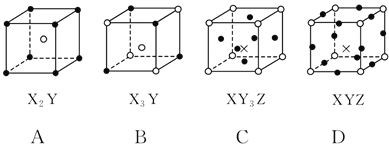
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E��F�������ڱ���ǰ�����ڵ�Ԫ�أ����ǵĺ˵����A<B<C<D<E<F������Aԭ�ں���������δ�ɶԵ��ӣ�������B2EΪ���Ӿ��壬Eԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ�CԪ���ǵؿ��к�����ߵĽ���Ԫ�أ�D���ʵľ���������ͬ���ڵĵ�����û����ͬ�ģ�Fԭ��������������B����ͬ�����������������ӡ������������Ϣ���ش���������(����ʱ��A��B��C��D��E��F������Ӧ��Ԫ�ط��ű�ʾ)��
��1��A��B��C��D�ĵ�һ��������С�����˳��Ϊ_______________________________��
��2��B���Ȼ�����۵��D���Ȼ�����۵�________(����������������)��������___________��
��3��A���⻯������е�����ԭ�Ӳ�ȡ________�ӻ���E�ĵͼ���������ӵ����幹����______��
��4��F�ĺ�������Ų�ʽ��______________��F�ĸ�������A�ļ��⻯���γɵ������ӵĻ�ѧʽΪ________��
��5��A��F�γ�ij�ֻ�����ľ����ṹ��ͼ��ʾ(����A�ԣ�3��)�����仯ѧʽΪ________(ÿ�������ʾ1��ԭ��)��

��6��A��C�γɵĻ�������и߷е��Ӳ�ȣ���һ���������ǽ������ϣ����仯ѧʽΪ________���侧���������Ļ�ѧ������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ŀ��Ϣ������з���ʽ��
(1)��(Ti)��Ϊ�������������Խ��Խ�������ǵĹ�ע���ؿ��к�������ʯ֮һ�ǽ��ʯ(TiO2)��Ŀǰ���ģ�����ķ����ǣ�
��һ�������ʯ��̿�ۻ�ϣ��ڸ��������£�ͨ��Cl2�Ƶ�TiCl4��һ�ֿ�ȼ���壬�÷�Ӧ�Ļ�ѧ����ʽΪ��____________________________________________��
�ڶ�����������������У��ù�����þ�ڼ�����������TiCl4��Ӧ�Ƶý����ѡ�д���˷�Ӧ�Ļ�ѧ����ʽ��____________________________________________��
(2)��100mL 0.1mol/L��NaOH��Һ����224mLCO2����(��״��)��ǡ����ȫ���ա��ٽ�������Һ����100mL 0.1mol/L����������Һ�С���д��������Һ������������Һ��Ӧ�����ӷ���ʽ��_________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̫���ܵ���е�����̫���ܵ�ء��ྦྷ��̫���ܵ�ء�GaAs̫���ܵ�ؼ�ͭ��������Ĥ̫���ܵ�صȡ�
��1��Cu+�ڻ�̬ʱ�ļ۵����Ų�ʽΪ__________________��
��2���顢���ǵ������ڵ�����Ԫ�أ���֪��ĵ�һ�����ܴ����������ԭ�ӽṹ�ĽǶȼ��Խ���___________________________��
��3��GaAs�۵�1238�棬�������ܼ����侧������Ϊ_____________��
��4��AsF3�Ŀռ乹���ǣ�______________��
��5�����ᣨH3BO3���������ܵ����H+����ˮ�����һ��OH-����[B(OH)4]-�������������ԡ�
��[B(OH)4]-��Bԭ�ӵ��ӻ�����Ϊ________��
��[B(OH)4]-�ĽṹʽΪ____________________��
��6�����ʯ�ľ�����ͼ�����Թ�ԭ�Ӵ�����ʯ�����е�̼ԭ�ӣ���õ�����裺�������ʯ������һ���̼ԭ�ӓQ�ɹ�ԭ�ӣ���̼����ԭ�ӽ��棬���õ�̼���辧�壨���ɰ����

�ٽ��ʯ������衢̼������۵��ɸߵ��͵�����˳����_______________________(�û�ѧʽ��ʾ)��
������������BN������Ľṹ����ʯ���ƣ�Ӳ������ʯ�൱��������������ܶ��Ǧ� g���M-3�������߳�Ϊ___________��(ֻҪ������ʽ�����ؼ������ֵ������٤������ΪNA)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ò�ͬ������O��O���ļ����ͼ����������±�������X��Y�ļ���������δ�ⶨ�����ɸ��ݹ������Ƶ����ܵĴ�С˳��ΪW>Z>Y>X��
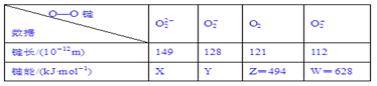
��1����������ܵĹ�ϵ������_________________________________________��
��2����������������Ĺ�ϵ������______________________________________��
��3����������������Ĺ�ϵ������_______________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com