
| A. | 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| B. | 可采取加热蒸发的方法使FeCl3从水溶液中结晶析出 | |
| C. | NaAlO2浓液中滴加Na2C03溶液,有沉淀和气体生成 | |
| D. | 将SO2分别通入硝酸钡溶液和溶有氨气的氯化钡溶液中,产生沉淀的成分相同 |
分析 A.碳酸钙溶解度较小,且可溶于盐酸;
B.氯化铁易水解生成氢氧化铁;
C.偏铝酸钠与碳酸钠溶液不反应;
D.二氧化硫与硝酸钡溶液发生氧化还原反应生成硫酸钡沉淀,与溶有氨气的氯化钡溶液反应生成亚硫酸钡沉淀.
解答 解:A.CaCO3的溶解度小于CaSO4,且与盐酸反应,故CaSO4用饱和Na2CO3溶液浸泡可转化为溶解度更小的CaCO3,然后再用稀盐酸溶解除去,故A正确;
B.氯化铁易水解生成氢氧化铁,制备氯化铁,应在盐酸氛围中加热,抑制水解,故B错误;
C.偏铝酸钠与碳酸钠溶液不反应,故C错误;
D.二氧化硫与硝酸钡溶液发生氧化还原反应生成硫酸钡沉淀,与溶有氨气的氯化钡溶液反应生成亚硫酸钡沉淀,生成沉淀不同,故D错误.
故选A.
点评 本题综合考查元素化合物知识,为高考常见题型,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:实验题
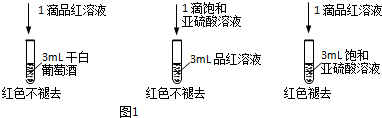
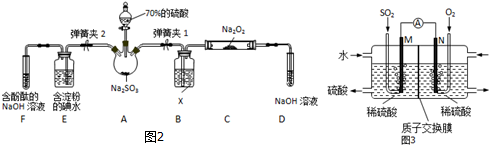
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Na2S2O3溶液,无明显现象 | |
| B. | 该溶液中Na+、K+、SiO32-、SO42-可以大量共存 | |
| C. | 加入FeCO3粉末,发生反应的离子方程式为:2FeCO3+2H+=2Fe2++CO2↑+H2O | |
| D. | 加入过量Cu粉和足量稀硫酸,可使溶液中几乎不含N元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
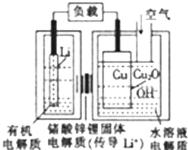 某锂电池的结构如图所示,该电池放电过程中的一个电极反应式为Cu2O+2e-+H2O=2Cu+2OH-,下列说法正确的是( )
某锂电池的结构如图所示,该电池放电过程中的一个电极反应式为Cu2O+2e-+H2O=2Cu+2OH-,下列说法正确的是( )| A. | 放电时,Li+透过固体电解质向Li极移动 | |
| B. | 放电时,负极的电极反应式为Li-e-+OH-=LiOH | |
| C. | 放电时,水溶液的pH不断升高 | |
| D. | 放电过程中需要不断地补充Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往装有铁钉的试管中加入2 mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,可以观察到铁钉表面粘附气泡,同时周围出现蓝色沉淀 | |
| B. | 在测定大理石与盐酸反应速率的实验中,用排水法测量一定时间内收集气体的体积 | |
| C. | 皂化反应后的混合液,需加入热饱和NaHCO3溶液,会有高级脂肪酸钠析出,然后再分液得到肥皂 | |
| D. | 在简易量热计测定反应热时,取用浓度均为0.5mol•L-1稀盐酸和氢氧化钠溶液各50mL、缓慢混合并搅拌使酸和碱充分反应、准确读取实验时温度计最高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 基于硫代硫酸钠与稀硫酸反应生成S和SO2,在定量测定反应速率时,既可用S对标记遮盖法,也可用排水法测SO2体积,计算出其反应速率 | |
| B. | 将两块未擦去氧化膜的铝片分别投入1mol?L-1CuSO4溶液、1mol?L-1CuCl2溶液中,一段时间后,铝片表面都观察不到明显的反应现象 | |
| C. | 将20g硝酸钠和17g氯化钾放入100ml烧杯中,加35mL水,并加热、搅拌,使溶液浓缩至约为原来的一半时,趁热过滤即可得到硝酸钾晶体 | |
| D. | 试管内壁附着的硫黄可以用热的KOH溶液洗涤,也可以用CS2洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
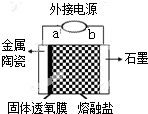 我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )
我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过.下列说法不正确的是( )| A. | a 极是电源的正极,Ti4+在熔融盐中从左往右迁移 | |
| B. | 阳极电极反应式为2Cl--2e-=Cl2↑ | |
| C. | 已知每摩尔电子的电量为965 00 C,理论上生成48mg钛,则电解过程中通过电解池的电量为386 C | |
| D. | NaCl-NaF融盐的作用是降低熔化TiO2需要的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
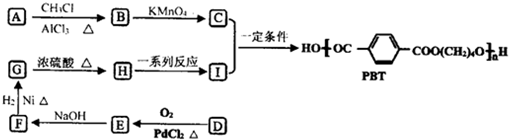

 ,B的核磁共振氢谱有2个峰.
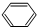
,B的核磁共振氢谱有2个峰.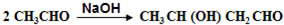 .
.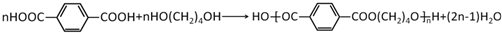 ,该反应类型为缩聚反应.
,该反应类型为缩聚反应.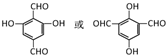 或
或 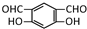 (任写一种).
(任写一种).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com