
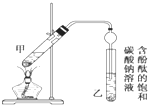
 某学生在实验室制取乙酸乙酯的主要步骤如下:
某学生在实验室制取乙酸乙酯的主要步骤如下:| 实验 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| ① | 2 | 2 | 1.33 |
| ② | 3 | 2 | 1.57 |
| ③ | 4 | 2 | x |
| ④ | 5 | 2 | 1.76 |
| ⑤ | 2 | 3 | 1.55 |
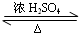 CH3COOC2H5+H2O,
CH3COOC2H5+H2O,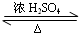 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑤ | B、②③⑦⑧ |
| C、③⑤⑥⑦ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
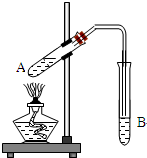 某同学在实验室用下图所示实验装置制取乙酸乙酯.回答下列问题:
某同学在实验室用下图所示实验装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,由x g NO2和y g N2O4组成的混合气体中原子总数为3NA,则x+y=46 |
| B、1 mol氯气参加氧化还原反应,一定得到NA 或2NA个电子 |
| C、1升0.1 mol?L-1 NaBr溶液中,HBr和Br-总和为0.1NA个 |
| D、12.5 mL 16 mol?L-1浓硫酸与足量铜反应,生成SO2的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
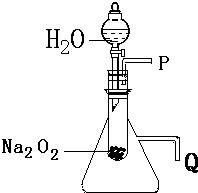 用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(CH3COO-)>c (OH-)>c(H+) |
| B、c(Na+)=c(CH3COO-),c(CH3COO-)>c (OH-)>c(H+) |
| C、c(Na+)>c (OH-)>c(CH3COO-)>c(H+) |
| D、c(Na+)>c (OH-)>c(H+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L水中所含的分子数约为6.02×1023 | ||
B、标准状况下,aL的氧气和氮气的混合物中含有的分子数约为
| ||
| C、常温常压下,含NA个O3分子的气体的物质的量小于1 mol | ||
| D、28gCO与16gO2的体积比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、证明FeCl2溶液被氧化(KSCN溶液) |
| B、除去C2H2中的H2S气体(CuSO4溶液) |
| C、鉴别SO2和CO2两种气体(溴水) |
| D、检验Na2SO4溶液中是否混有NaCl(AgNO3溶液) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com