
| A. | 聚丙烯的链节:-CH2CH(CH3)- | B. | 乙酸的分子式:CH3COOH | ||
| C. | 对硝基苯酚的结构简式: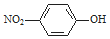 | D. | H2S的电子式: |
分析 A.链节指组成聚合物的每一基本重复结构单元,聚丙烯为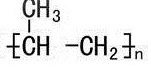 ,所以聚丙烯的链节为:-CH2CH(CH3)-;
,所以聚丙烯的链节为:-CH2CH(CH3)-;
B.分子式是指用元素符号表示纯净物(单质、化合物)分子的组成及相对分子质量的化学式,乙酸的分子式为C2H4O2,结构简式为CH3COOH;
C.对硝基苯酚中的硝基应该是N与C相连接,而不是O与C相连;
D.电子式的书写首先要认清物质中由什么键组成,共价键是原子之间通过共用电子的方式成键,离子键是阴阳离子之间形成的,在形式上有本质区别.H2S为共价化合物.
解答 解:A.聚丙烯为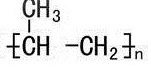 ,所以聚丙烯的链节为:-CH2CH(CH3)-,故A正确;
,所以聚丙烯的链节为:-CH2CH(CH3)-,故A正确;
B.乙酸的分子式为C2H4O2,选项中CH3COOH表示结构简式,故B错误;
C.对硝基苯酚中的硝基应该是N与C相连接,而不是O与C相连,故C错误;
D.H2S为共价化合物,选项中的电子式的形式表示的是离子化合物,故D错误.
故选:D.
点评 本题主要考查化学用语的基础知识,需要学生对基本的化学用语要特别的熟练.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
 5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水.
5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水.| 阳离子 | Na+ Al3+Fe3+ Cu2+、Ba2+ |
| 阴离子 | OH- Cl- CO32- NO3- SO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -332kJ | B. | -118kJ | C. | +130kJ•mol-1 | D. | +350kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “神州11号”用Na2O2作氧气的来源,是因为Na2O2能氧化CO2和水产生O2 | |
| B. | FeCl3溶液可用于铜质印刷线路板制作,是因为FeCl3能与铜单质发生置换反应 | |
| C. | Al2O3作耐火材料是因为氧化铝熔点高 | |
| D. | 氨常用作制冷剂利用了氨的化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
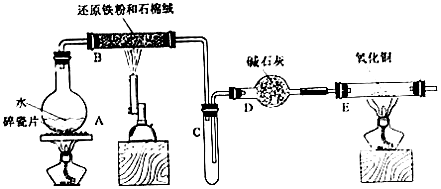
| 步骤 | 操作 | 甲组现象 | 乙组现象 | |
| 1 | 取黑色粉末加入稀盐酸 | 洛解,无气泡 | 溶解,无气泡 | |
| 2 | 取少骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 | |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 | |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
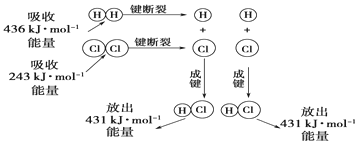
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al是地壳中含量最多的金属元素,但铝是使用较晚的金属 | |
| B. | Al是比较活泼的金属,在化学反应中容易失去电子,表现还原性 | |
| C. | Al箔在空气中受热可以熔化,且发生剧烈燃烧 | |
| D. | Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al并不滴落 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com