
| A. | 往品红溶液中通入SO2 | B. | NO中混入空气 | ||
| C. | 往氨水中滴加酚酞 | D. | 往Ba(OH)2溶液中滴加盐酸 |
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:解答题



| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2、Na2S03、FeCl3、KCl | B. | Na2Si03、Na2C03、KN03、NH4Cl | ||
| C. | NH3、H20、H3P04、Na2S04、H2S04 | D. | HCl、CH2COOH、C2H5OH、Na2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ Na+ NO3- CO32- | B. | Na十 Fe3+ SCN- SO42- | ||
| C. | K+ Na十 Cl- AlO2- | D. | Al3+ Na+ Cl- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
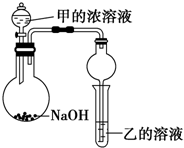 五种短周期元素的部分性质数据如下:
五种短周期元素的部分性质数据如下:| 元素 | T | X | Y | Z | W |
| 原子半径(nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| 最高或最低化合价 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
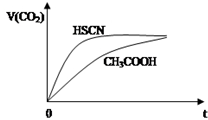 已知25℃时有关弱酸的电离平衡常数:
已知25℃时有关弱酸的电离平衡常数:| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2是还原产物 | |
| B. | NaOH是氧化产物 | |
| C. | Na2O2中,-1价的氧既得电子,又失电子 | |
| D. | Na2O2是氧化剂,水是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土 | |
| B. | PM2.5表面积大,能吸附大量的有毒、有害物质 | |
| C. | 高纯硅在太阳能电池及信息高速传输中有重要应用 | |
| D. | 从海水中提取物质不一定要通过化学反应实现 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com