
现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物。甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量。
甲组同学取了数分相同质量的样品A溶于水,然后分别加入不同体积的1mol/L的NaOH溶液,水浴加热至气体全部逸出。(此温度下,铵盐不分解)。该气体干燥后用足量的浓硫酸完全吸收。浓硫酸增重的质量与加入NaOH溶液的体积的关系如图。分析该图像,并回答下列问题: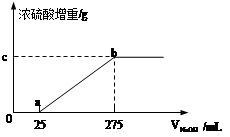
(1)写出ab段涉及的离子方程式: 。
(2)c点对应的数值是 ;样品A中(NH4)2SO4、NH4HSO4的物质的量之比为 。乙组同学取了数份不同质量的样品B,分别加入到200mL 1mol/L的NaOH溶液中,同样用水浴加热,将逸出气体干燥后再用浓H2SO4吸收。测定结果如下表:
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 铵盐的质量(g) | 9.88 | 19.76 | 29.64 | 49.40 |
| 浓硫酸增加的质量(g) | m | m | 1.36 | 0 |
(1)NH4+ + OH― = NH3↑+ H2O (1分)
(2)4.25 (2分) 9:2 (3分)
(3)①Ⅰ (1分) 2.04 (2分) ②17% (3分)
(4)12.35<x<49.4, y=3.4-17x/247 (4分)
解析试题分析:
(1)0-25ml: NaOH溶液与NH4HSO4中的H+作用:2NH4HSO4+2NaOH= (NH4)2SO4+Na2 SO4+2H2O
ab段:(NH4)2SO4+2NaOH="2" NH3↑+ 2H2O+ Na2 SO4 离子方程式:NH4+ + OH― = NH3↑+ H2O
(2)①解:设浓硫酸增重的质量为x
(NH4)2SO4+2NaOH="2" NH3↑+ 2H2O+ Na2 SO4
2 34
(275-25)/1000*1 x x="4.25" c点对应的数值是4.25
②样品A中(NH4)2SO4、NH4HSO4的物质的量之比为9/2
解:设NH4HSO4的物质的量为y
①2NH4HSO4+2NaOH= (NH4)2SO4+Na2 SO4+H2O
2 2 1
y 1*25/1000 0.025/2
y=0.025
② (NH4)2SO4+2NaOH="2" NH3↑+ 2H2O+ Na2 SO4
1 2
0.125 1*(275-25)/1000
原(NH4)2SO4:0.125-0.0125=0.1125(mol)
(NH4)2SO4、NH4HSO4的物质的量之比为0.1125/0.025=9/2
(3)I 和II可知,I铵盐最少,NaOH足量,铵盐能反应充分。浓硫酸增重的质量即氨的质量。
解:设I(第一份)NH4HSO4和(NH4)2SO4的物质的量为x和y,I中铵盐都反应了
115x+132y=9.88 放出的氨气的物质的量为x+2y
①NH4HSO4 ---------2NaOH----- NH3↑ (2)(NH4)2SO4--------2NaOH-----2 NH3↑
x x y 2y
第二份的质量是第一份的2倍,NH4HSO4的物质的量也为2倍,物质的量为2x
对于第二份:先NH4HSO4---------H+ ---------OH-
2x 2x 2x
第二份吸收氨的质量与第一份等,物质的量也等。
NH4+---------OH-
x+2y x+2y 有NaOH:2x+ x+2y=0.2*1 和115x+132y=9.88 x=0.04 y=0.04
放出的氨气的物质的量为x+2y="0.12" 放出的氨气的质量为:m=17*0.12=2.04(g)
②样品B中氮元素的质量分数:14(x+2y)*100%/9.88=17%
60、由I可知样品B中NH4HSO4和(NH4)2SO4的物质的量均为0.04 mol,是物质的量1:1混合。
假设样品的质量为x(g),浓硫酸增重的质量为y(g)。有几个特殊点
(1)0.2 molNaOH恰好反应需NH4HSO4和(NH4)2SO4的质量x(g),设NH4HSO4和(NH4)2SO4的物质的量均为n
NH4HSO4-----------2NaOH ----------- NH3↑ ;(NH4)2SO4-----------2NaOH----------- 2NH3↑
n 2n n n 2n 2n
对于NaOH :4n=0.2 n="0.05" 样品的质量 x=115*0.05+132*0.05=12.35(g)
浓硫酸增重的质量为y:即氨的质量:3n*17
(2)浓硫酸增重的质量为0时,样品的质量为x(g),此时NaOH 量不足,只与H+反应
NH4HSO4- ----------NaOH
0.2 0.2
样品B中的质量为x:0.2*115+0.2*132="49.4(g)" 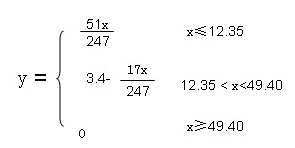
当x大于等于49.4 y=0 ;x小于等于12.35 ,NH4HSO4和(NH4)2SO4物质的量1:1混合,物质的量为x/247,含氨气3 x/247,质量为y="17*3" x/247=51x/247。12.35<x<49.4, y=3.4-17x/247
考点:本题以实验为基础,考查化学计算等知识。


科目:高中化学 来源: 题型:计算题
配制250ml 1.0 mol/L 的Na2CO3溶液,需称取Na2CO3固体多少克?取配制好的溶液25ml,往其中逐滴滴加1.0 mol/L的H2SO4溶液15ml,求生成的气体在标准状况下的体积是多少升?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
足量的锌加入100mL的盐酸溶液中反应,生成标准状况下的H24.48L。回答:
(1)盐酸溶液的物质的量浓度。
(2)取该盐酸溶液10mL,加水稀释至100mL,求稀释后所得溶液的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在25℃,101kPa条件下,将15 L O2通入10 L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1) 若剩余气体的体积是15L,则原CO和H2的混合气中V(CO)= L, V(H2)= L。
(2)若剩余气体的体积为aL,则a的取值范围是: 计算过程:
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
小苏打、胃舒平、达喜都是常用的中和胃酸的药物。
(1)小苏打每片含0.50gNaHCO3,2片小苏打片和胃酸完全中和,被中和的H+是 mol。
(2)胃舒平每片含0.245gAl(OH)3,中和胃酸时,6片小苏打相当于胃舒平 片。
(3)达喜的化学成分是铝和镁的碱式盐:取该碱式盐3.01g,加入2.0mol/L盐酸使其溶解,当加入盐酸42.5mL时开始产生CO2,加入盐酸至45.0mL时正好完全反应,计算该碱式盐样品中氢氧根与碳酸根的物质的量之比 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
工业上生产硫酸的原料,一种是黄铁矿,其主要成分为FeS2(S为-1价);另一种是磁黄铁矿,其主要成分是Fe1-xS(S为-2价),式中x通常为0.1~0.2,既含有Fe2+又含有Fe3+。
生产硫酸时将矿石煅烧,发生反应如下:
① 4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2
② 4 Fe1-xS + (7-3x) O2 → 2 (1-x) Fe2O3 + 4 SO2
(1)含FeS2 72%的黄铁矿10吨,理论上最多可以生产98%的浓硫酸 吨(矿石中无其他含硫物质)。
(2)若磁黄铁矿Fe1-xS中x=0.1,则Fe1-xS中Fe2+与Fe3+的物质的量之比为 :1。
(3)煅烧矿石时,为了尽可能地将矿石中的硫转变为SO2,需通入过量20%的空气(其中N2与O2的体积比为4:1,假设无其他气体成分),计算磁黄铁矿充分煅烧后排出的气体中SO2的体积分数(用含x的代数式表示)。
(4)将一定量的磁黄铁矿溶于足量的盐酸,充分反应后测得生成S单质2.4g,FeCl2 0.425mol,且溶液中无Fe3+,计算Fe1-xS中的x值(矿石中其他成分不与盐酸反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在200mL的混合溶液中,硝酸和硫酸的物质的量的浓度均为0.2mol/L,向该混合液中加入3.84g的铜,加热使其充分反应。试计算:
(1)理论上生成的一氧化氮(标准状况下)的体积是多少升?
(2)若反应后溶液的体积不发生变化,溶液中Cu2+物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL、0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥容量瓶⑦托盘天平⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有 (填代号)。
(2)经计算,需浓H2SO4的体积为 mL(保留一位小数)。现有①10 mL ②50 mL ③100 mL三种规格的量筒,你选用的量筒是 (填代号)
(3)在配制过程中,其他操作都准确,下列操作中:错误的是 ,能引起实验结果偏高的有 (填代号)。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com