

分析 (1)NaCN为强碱弱酸盐,水解呈碱性;
(2)非金属性强的元素显示负价,非金属性弱的则显示正价;非金属的非金属越强,其最高价氧化物的水化物酸性越强.
(3)NaCN用双氧水处理产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,说明二者反应生成氨气、和碳酸氢钠;
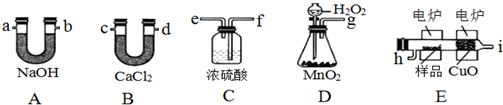
【实验一】a装置制备二氧化硫,c装置中制备Na2S2O3,反应导致装置内气压减小,b为安全瓶作用,防止溶液倒吸,d装置吸收多余的二氧化硫,防止污染空气.
(4)由仪器结构特征,b装置为安全瓶,防止溶液倒吸;d装置吸收二氧化硫,d中溶质有NaOH、Na2CO3,碱过量,还有亚硫酸钠生成;
(5)实验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收;关闭K2打开K1拆除装置,防止污染空气;
【实验二】(6)Ag+与CN-反应生成[Ag(CN)2]-,当CN-反应结束时,Ag+与I-生成AgI黄色沉淀,说明反应到达滴定终点;
(7)计算消耗硝酸银物质的量,再根据方程式Ag++2CN-=[Ag(CN)2]-计算出氰化钠的含量与废水中氰化钠的最高排放标准为0.50mg/L比较判断是否符合排放标准.
解答 解:(1)氰化钠化学式为NaCN(C元素+2价,N元素-3价),氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,NaCN为强碱弱酸盐,水解呈碱性,反应的离子方程式为:CN-+H2O?HCN+OH-,
故答案为:CN-+H2O?HCN+OH-;
(2)CN-中C元素显+2价,N元素显-3价,说明N非金属性强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,其检验方法为:取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C;
故答案为:>;取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C;
(3)用双氧水处理氰化钠,产生一种能使湿润的红色石蕊试纸变蓝的气体为氨气,根据原子守恒一种酸式盐为碳酸氢钠,所以反应为:NaCN+H2O2+H2O═NaHCO3+NH3↑,离子反应为:CN-+H2O2+H2O═HCO3-+NH3↑,
故答案为:CN-+H2O2+H2O═HCO3-+NH3↑;
【实验一】a装置制备二氧化硫,c装置中制备Na2S2O3,反应导致装置内气压减小,b为安全瓶作用,防止溶液倒吸,d装置吸收多余的二氧化硫,防止污染空气.
(4)由仪器结构特征,可知b装置为安全瓶,防止倒吸,d装置吸收二氧化硫,d中溶质有NaOH、Na2CO3,碱过量,还有亚硫酸钠生成,
故答案为:安全瓶,防止倒吸;Na2SO3;
(5)实验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收,氢氧化钠和二氧化硫反应生成亚硫酸钠和水,再关闭K2打开K1,防止拆除装置时污染空气,
故答案为:NaOH溶液;关闭K2打开K1;
【实验二】(6)Ag+与CN-反应生成[Ag(CN)2]-,当CN-反应结束时,滴入最后一滴硝酸银溶液,Ag+与I-生成AgI黄色沉淀,说明反应到达滴定终点,
故答案为:滴入最后一滴硝酸银溶液,出现淡黄色沉淀;
(7)消耗AgNO3的物质的量为1.5×10-3L×0.0001mol/L=1.50×10-7mol,根据方程式Ag++2CN-=[Ag(CN)2]-,处理的废水中氰化钠的质量为1.50×10-7mol×2×49g/mol=1.47×10-5g,废水中氰化钠的含量为$\frac{1.47×1{0}^{-2}mg}{0.02L}$=0.735mg/L>0.50mg/L,处理后的废水未达到达到排放标准,
故答案为:否;消耗AgNO3的物质的量为1.5×10-3L×0.0001mol/L=1.50×10-7mol,根据方程式Ag++2CN-=[Ag(CN)2]-,处理的废水中氰化钠的质量为1.50×10-7mol×2×49g/mol=1.47×10-5g,废水中氰化钠的含量为$\frac{1.47×1{0}^{-2}mg}{0.02L}$=0.735mg/L>0.50mg/L,处理后的废水未达到达到排放标准.
点评 本题考查物质制备实验、物质含量测定等,题目综合性较强,关键是对原理的理解,注意制备中渗入环保意识,熟练掌握元素化合物知识与实验制备基本原则,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 30℃ | B. | 35℃ | C. | 40℃ | D. | 45℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2通入负极区 | B. | O2通入正极区 | ||
| C. | 负极反应为2H2+4OH--4e-═4H2O | D. | 正极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖能水解成乙醇和二氧化碳 | |
| B. | 氨基乙酸、甲醛、乙二醇均可自身或与其他物质发生聚合反应 | |
| C. | 苯酚能跟碳酸钠溶液反应,则苯酚的酸性比碳酸强 | |
| D. | 实验室用溴乙烷在浓硫酸存在并加热条件下制备乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaHCO3 HCl | B. | Na2CO3 HCl | C. | AlCl3 NaOH | D. | CaCl2 Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②③④⑥ | C. | ②③③⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  验证酸性:H2CO3>H2SiO3 | B. |  实验室制取氨气 | ||
| C. |  证明石蜡油分解生成的气体是乙烯 | D. | 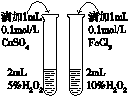 比较不同催化剂对反应速率的影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com