
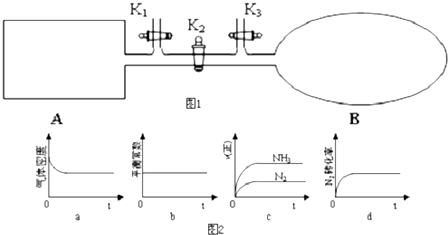
分析 ①可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
②随反应进行混合气体物质的量减小,A是恒温恒容,B是恒温恒压,故平衡时A的压强比B中的小,B等效为在A中平衡基础上增大压强,平衡正向移动;
③打开K2,一段时间又达到平衡时,等效为开始通入3molN2和9molH2再恒温恒容到达的平衡,与B中平衡为等效平衡,平衡时同种物质的转化率相等,则平衡时混合气体物质的量为B中平衡时的3倍,根据恒温恒压下体积之比等于物质的量之比计算平衡时气体体积,减去A容器体积即为B的体积.
解答 解:①a.混合气体总质量一定,容器A的容积不变,故密度数值不变,所以不能说明反应达到平衡状态,故a错误;
b.恒温条件下,平衡常数保持不变,则不能说明反应达到平衡状态,故b错误;
c.随反应进行氮气速率减小、氨气速率增大,图象中速率变化不符合,故c错误;
d.N2的转化率先增大,后保持不变,说明反应达到平衡状态,故d正确;
故答案为:d;
②随反应进行混合气体物质的量减小,A是恒温恒容,B是恒温恒压,故平衡时A的压强比B中的小,B等效为在A中平衡基础上增大压强,平衡正向移动,则N2转化率的关系:α(A)<α(B),
故答案为:<;
③打开K2,一段时间又达到平衡时,等效为开始通入3molN2和9molH2再恒温恒容到达的平衡,与B中平衡为等效平衡,平衡时同种物质的转化率相等,则平衡时混合气体物质的量为B中平衡时的3倍,恒温恒压下体积之比等于物质的量之比,故平衡时气体体积为0.8a L×3=2.4a L,则B的体积为2.4a L-aL=1.4a L,
故答案为:1.4a L.
点评 本题考查化学平衡计算与影响因素、平衡状态判断、化学平衡图象,③中关键是对等效平衡规律的理解掌握.


科目:高中化学 来源:2017届湖北省高三联合考试化学试卷(解析版) 题型:选择题
化合物Mg5Al3(OH)x(H2O)4可作环保型阻燃材料,受热时会发生如下分解反应(其中M是某种物质,a为化学计量数):2Mg5Al3(OH)x(H2O)4 27H2O↑+10M+aAl2O3下列说法正确的是
27H2O↑+10M+aAl2O3下列说法正确的是
A.a=2
B.x=18
C.M的化学式为MgO
D.该反应中Mg5Al3(OH)x(H2O)4既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
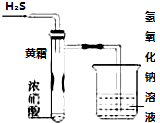 某同学用下列实验装置探究硝酸的性质.根据图示判断下列结论不正确的是
某同学用下列实验装置探究硝酸的性质.根据图示判断下列结论不正确的是| A. | 试管内壁上“黄霜”的成分是硫 | |
| B. | 该实验探究说明浓硝酸既有氧化性,又有挥发性 | |
| C. | 烧杯内的NaOH溶液的作用是除去尾气,防止尾气污染环境 | |
| D. | H2S用SO2代替,将无明显反应现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水解平衡正向移动 | B. | 各微粒浓度均变小 | ||
| C. | 溶液中离子数目增多 | D. | c(Al3+)与c(SO42-)的比值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. |  | ||
| C. |  | D. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④>③>②>① | B. | ③>④>②>① | C. | ②>③>④>① | D. | ③>②>④>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开啤酒瓶盖,产生大量气泡 | |
| B. | 稀释CH3COOH时,溶液中CH3COO-数目增多 | |
| C. | 工业合成氨常用500℃左右的温度 | |
| D. | 热的纯碱溶液的去污效果比冷的好 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com