
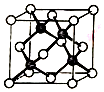
 冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或圆心,实心球所示原子位于立方体内)类似.下列有关冰晶胞说法合理的是( )
冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或圆心,实心球所示原子位于立方体内)类似.下列有关冰晶胞说法合理的是( )| A. | 冰晶胞内水分子间以共价键结合 | |
| B. | 晶体冰与金刚石晶体硬度都很大 | |
| C. | 冰分子间的氢键无方向性和饱和性 | |
| D. | 氢键存在导致冰晶胞与金刚石晶胞排列方式类似 |
分析 水分子间存在氢键,水分子间的氢键具有方向性,每个水分子中一个氧原子可以和另外2个水分子中的氢原子形成2个氢键,2个氢原子可以和另外2个水分子中的氧原子形成氢键,所以每个水分子可与相邻的4个水分子形成4个氢键,导致冰晶胞与金刚石晶胞微粒排列方式相似,但冰为分子晶体,熔沸点较低,乙醇解答该题.
解答 解:A.共价键存在于分子内,水分子间为分子间作用力,这里主要是氢键,故A错误;
B.晶体冰属于分子晶体,硬度较小,故B错误;
C.水分子间的氢键具有方向性和饱和性,故C错误;
D.由以上分析可知氢键存在导致冰晶胞与金刚石晶胞排列方式类似,故D正确.
故选D.
点评 本题考查晶体知识,为高频考点,侧重考查学生的分析能力,主要晶体的类型和性质以及氢键与共价键、分子间作用力的区别,难度不大.


科目:高中化学 来源: 题型:解答题
 (1)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
(1)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  可用于吸收多余的NO | |
| B. |  可用于检验SO2的漂白性 | |
| C. |  可用于比较Fe与Cu的金属活动性强弱 | |
| D. |  可用于测定CO2的生成速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>X>Y>Z | |
| B. | 简单氢化物的稳定性:W<X | |
| C. | 最高价氧化物对应水化合物的碱性:Y>Z | |
| D. | Y的单质可以将Z从可溶性盐溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3+2HCl=CaCl2+H2O+CO2↑ | B. | Cu+2AgNO3=2Ag+Cu(NO3)2 | ||
| C. | CaO+H2O=Ca(OH)2 | D. | 3NaOH+FeCl3=3NaCl+Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂的目的是提高反应物的转化率 | |
| B. | 循环使用N2、H2的目的是提高氨的产率 | |
| C. | 温度控制在500℃左右的目的是有利于化学平衡向正反应方向移动 | |
| D. | 高压下反应有利于增大反应速率,所以压强越高越好 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,将 4molSO2和2molO2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态 A 时,测得气体总物质的量为 4.2mol.若SO2、O2、SO3的起始物质的量分别用 a、b、c表示,回答下列问题:
如图所示,将 4molSO2和2molO2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态 A 时,测得气体总物质的量为 4.2mol.若SO2、O2、SO3的起始物质的量分别用 a、b、c表示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 毛织、丝织衣服不宜用加酶洗衣粉洗涤 | |
| B. | 纤维素、淀粉、油脂均为天然高分子化合物 | |
| C. | 由煤的干馏可知煤中含甲苯、二甲苯、苯酚等芳香族化合物 | |
| D. | 向蛋白质溶液中滴入CuSO4溶液,蛋白质聚沉后还能溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com