
| 2 |
| 20 |
| 0.01 |
| 5 |
| 2 |
| 20 |
| 0.01 |
| 5 |


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
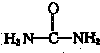 )与NO2-在酸性条件下反应生成两种无毒气体.该反应中生成16.8L(已折算为标准状况)混合气体时,消耗尿素的质量为
)与NO2-在酸性条件下反应生成两种无毒气体.该反应中生成16.8L(已折算为标准状况)混合气体时,消耗尿素的质量为查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省长沙市高三第二次月考化学试卷(解析版) 题型:填空题
近年来,许多专家对石灰氮重新进行了深入研究,这也使得石灰氮这一古老的肥料又焕发了新的活力。石灰氮是由Ca、N、C等三种元素组成的盐,其含钙、氮的质量分数分别为50%、35%。石灰氮完全水解后的产物是固体A和气体B,其中B是制取氮肥的主要原料。固体A在高温下分解生成D和气体C。B的催化氧化产物为E和F,F继续氧化后的产物G遇到E生成一种工业强酸。将G和F的混合物溶解在接近零度的水中,即生成亚硝酸的水溶液,该反应可表示如下G+F+H2O=2HNO2(已配平)。请回答下列问题:
(1)石灰氮的化学式为 。
(2)足量B和C与饱和氯化钠溶液的反应是化工生产中生产某种重要化工产品的重要反应,试写出其化学方程式 。
(3)亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。在酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I— 被氧化为I2时,含氮产物为 (填化学式)。要得到稳定HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质中不适合使用是 (填序号)。
a、磷酸 b、二氧化碳 c、稀硫酸 d、二氧化硫 e、次氯酸
(4)工业废水中的NO2— 可用铝粉除去。已知此反应体系中包含Al、NaAlO2、NaNO2、NaOH、NH3、H2O六种物质。写出上述反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:浙江省模拟题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com