
| A. | 氧气和臭氧(O3)是氧元素的同素异形体 | |
| B. | 乙酸和甲酸甲酯是同分异构体 | |
| C. | 12C和13C互为同位素 | |
| D. | 软脂酸(C15H31COOH)和油酸(C17H33COOH)是同系物 |
分析 A.同种元素形成的结构不同的单质互称同素异形体;
B.分子式相同结构不同的化合物互称同分异构体;
C.质子数相同中子数不同的原子互称同位素;
D.同系物指分子结构相似,在组成形成1个或若干个CH2原子团物的质.
解答 解:A.氧气和臭氧是氧元素形成的结构不同单质,互为同素异形体,故A正确;
B.乙酸和甲酸甲酯分子式相同,结构不同,互为同分异构体,故B正确;
C.12C和13C质子数相同,中子数不同,是碳元素的不同核素,互为同位素,故C正确;
D.油酸含碳碳双键,软脂酸无碳碳双键,含官能团不同,不是同系物,故D错误.
故选D.
点评 本题考查了同位素、同系物、同分异构体、同素异形体的概念与区别,难度不大,注意把握概念的内涵与外延.


科目:高中化学 来源: 题型:选择题
| A. | 有一种第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性.纳米泡沫碳与金刚石的转化是化学变化 | |
| B. | NO2能与水反应生成硝酸,所以NO2是酸性氧化物 | |
| C. | 铝粉和氧化镁粉末可以组成铝热剂发生铝热反应 | |
| D. | 某元素的气态氢化物能与其最高价氧化物对应的水化物发生化学反应,则该元素一定是N元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,该反应属于取代反应,有机物的名称是硝基苯.
,该反应属于取代反应,有机物的名称是硝基苯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5730×3年 | B. | 5730×4年 | C. | 5730×6年 | D. | 5730×8年 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
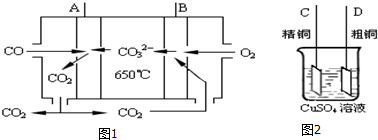
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
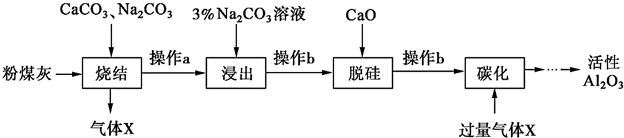
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②⑤ | D. | ④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com