
(13分)A、B、C、D、E、F六种化合物,其中A、B、C、D、E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成。B、C的组成元素相同,且C的摩尔质量比B大80g/mol ,回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为
A、离子键 B、极性共价键 C、非极性共价键 D、氢键
二、 下表为B与F实验的部分内容
|
①在含B的溶液中加入稀 |
|
②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
|
③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
写出B与稀 反应的离子方程式
反应的离子方程式
写出②中反应的化学方程式
(3)现由6种粒子 、
、 、
、 、
、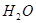 、
、 (C中含有的阴离子),
(C中含有的阴离子),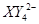 完成一个离子方程式,已知
完成一个离子方程式,已知 为还原剂,得到1mol
为还原剂,得到1mol 需氧化剂的物质的量为 mol
需氧化剂的物质的量为 mol
(4)化合物D和E相互转化D E,若有D和E ·
E,若有D和E · H2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为
g,E ·
H2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为
g,E ·
 的化学式为
的化学式为
(1)AC(2分)(2)S2O32- + 2H+ = S↓ + SO2 + H2O(2分)
Fe3+ + 3H2O  Fe(OH)3(胶体)+3H+(2分)
Fe(OH)3(胶体)+3H+(2分)
(3)2.5(2分) (4)8.4 (2分) Na2CO3·7H2O(3分)
【解析】(1)根据颜色可知A是过氧化钠,含有的化学键是离子键和非极性键。
(2)根据B和稀硫酸反应的现象可知,B是Na2S2O3,反应式为S2O32- + 2H+ = S↓ + SO2
+ H2O。根据反应②③可知F是氯化铁,反应式为Fe3+ + 3H2O  Fe(OH)3(胶体)+3H+。
Fe(OH)3(胶体)+3H+。
(3)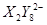 为S2O82-,还原产物是SO42-,S的化合价升高1个单位。1mol还原剂失去5mol电子,所以根据得失电子守恒可知,需要氧化剂的物质的量是2.5mol。
为S2O82-,还原产物是SO42-,S的化合价升高1个单位。1mol还原剂失去5mol电子,所以根据得失电子守恒可知,需要氧化剂的物质的量是2.5mol。
(4)D是碳酸氢钠,分解生成CO2和H2O以及碳酸钠。气体产物通过浓H2SO4增重3.42g,则生成物水是3.420g。剩余气体通过碱石灰增重2.20g,则CO2是2.20g,物质的量是0.05mol,则碳酸氢钠是0.1mol,质量是8.4g。分解生成的水是0.05mol,质量是0.9g,E ·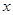 H2O中水的质量是2.52g,物质的量是0.14mol。Na2CO3·XH2O的质量是13.04g-8.4g=4.64g。其中碳酸钠的质量是4.64g-2.52g=2.12g,物质的量是0.02mol,即个数之比是1︰7,所以化学式为Na2CO3·7H2O。
H2O中水的质量是2.52g,物质的量是0.14mol。Na2CO3·XH2O的质量是13.04g-8.4g=4.64g。其中碳酸钠的质量是4.64g-2.52g=2.12g,物质的量是0.02mol,即个数之比是1︰7,所以化学式为Na2CO3·7H2O。


科目:高中化学 来源: 题型:阅读理解
| 氟化物 | X | Y | Z |
| 熔点/K | 1266 | 1534 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com