
【题目】能正确表示下列反应的离子方程式是( )
A. 将钠块投入到CuSO4溶液中:2Na+Cu2+=Cu+2Na+
B. 向沸水中滴加饱和FeCl3溶液制胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
C. KMnO4溶液中加H2O2,紫色褪去:2MnO4-+H2O2+6H+=2Mn2++3O2↑+4H2O
D. 用小苏打治疗胃酸过多:HCO3-+H+=H2O+CO2↑
【答案】D
【解析】A.钠先与水反应,生成的氢氧化钠再与硫酸铜反应;B.Fe(OH)3为胶体,不是沉淀;C.电子得失不守恒;D.碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳。
钠非常活泼,与水先反应生成氢氧化钠和氢气,氢氧化钠再与硫酸铜反应生成氢氧化铜和硫酸钠,离子反应方程式为:2Na+Cu2++2H2O=Cu(OH)2↓+2Na++H2↑,A错误;向沸水中滴加饱和FeCl3溶液制胶体,不是沉淀,离子反应方程式为:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,B错误;KMnO4溶液中加H2O2,H2O2为还原剂,被氧化为氧气,离子反应方程式为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,C错误;用小苏打治疗胃酸过多离子反应方程式为:HCO3-+H+=H2O+CO2↑;D正确;正确选项D。
Fe(OH)3(胶体)+3H+,B错误;KMnO4溶液中加H2O2,H2O2为还原剂,被氧化为氧气,离子反应方程式为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,C错误;用小苏打治疗胃酸过多离子反应方程式为:HCO3-+H+=H2O+CO2↑;D正确;正确选项D。


科目:高中化学 来源: 题型:
【题目】我国科研人员以传统中药为原料先制得化合物I,再转化为具有抗癌抑菌活性的化合物Ⅱ,有关转化如图所示,下列有关说法不正确的是( )
A.化合物I分子式为C19H24O5
B.化合物I 和Ⅱ均能与酸性KMnO4溶液和NaOH溶液反应
C.化合物Ⅱ一定条件下能发生取代、消去及加成反应
D.检验化合物Ⅱ中是否含化合物I可用Br2的CCl4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物PA66的合成路线如下:

已知:
(1)A属于芳香化合物,其结构简式是____________。
(2)①的化学方程式是____________。
(3)C中所含官能团的名称是____________。
(4)②的反应条件是____________。
(5)④的化学方程式是____________。
(6)![]() 有多种同分异构体,符合下列条件的有______种,写出其中任意一种同分异构体的结构简式:_____
有多种同分异构体,符合下列条件的有______种,写出其中任意一种同分异构体的结构简式:_____
i.为链状化合物且无支链;ii.为反式结构;III.能发生银镜反应。
(7)已知:RCH=CH2![]() RCH2CH2COOCH3
RCH2CH2COOCH3
有机物C可由2-丁烯经4步反应合成,请结合题中信息补充完整下列合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。____
CH=CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜——稀硫酸原电池的装置如图所示,下列叙述错误的是( )

A. 电流从锌片经导线流向铜片 B. 锌是负极,其质量逐渐减小
C. 氢离子在铜表面被还原,产生气泡 D. 依据该实验现象可判断锌比铜活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学分析中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液.实验室一般先称取一定质量的KMnO4晶体,配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]对配制的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为:5C2O42﹣+2MnO4﹣+16H+═10CO2↑+2Mn2++8H2O
以下是标定KMnO4溶液的实验步骤:
步骤一:先配制浓度约为0.10molL﹣1的高锰酸钾溶液500mL.
步骤二:取0.02molL﹣1 的Na2C2O420.00mL放入锥形瓶中,并加稀硫酸酸化,用步骤一所配高锰酸钾溶液进行滴定.三次平行实验的数据记录在表中:
平行实验编号 | Na2C2O4溶液 | 滴定管起始读数(mL) | 滴定管滴定终点读数(mL) |
① | 20.00 | 0.00 | 21.18 |
② | 20.00 | 1.02 | 21.00 |
③ | 20.00 | 1.18 | 21.20 |
试回答下列问题:
(1)步骤一中要用到的主要玻璃仪器是除烧杯、玻璃棒外还需 .
(2)步骤二中滴定操作选用滴定管(填“酸式”或“碱式”)滴定终点的判断方法:
(3)下来滴定操作会导致测量结果偏高的是
A.滴定管滴定前有气泡,滴定后气泡消失
B.锥形瓶洗涤后没有干燥
C.滴定终点时,读数时俯视
D.滴定时锥形瓶中有液体溅出
E.一滴高锰酸钾溶液附在锥形瓶壁上未冲下
(4)从实验所得数据计算,KMnO4溶液的浓度为molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验方案不能达到实验目的的是
编号 | A | B | C | D |
方案 |
|
|
V(CH4)∶V(Cl2)=1∶1 |
|
目的 | 较长时间看到Fe(OH)2沉淀 | 验证浓硫酸具有脱水性和强氧化性 | 在强光照条件下制取纯净的一氯甲烷 | 实验室制备乙酸乙酯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.2mol/LH2C2O4溶液中滴加0.2mol/LKOH溶液,水电离出氢离子浓度c(H+)与加入氢氧化钾溶液的体积的变化如下图,已知常温下,H2C2O4的电离常数为:K1=5.0×10-2,K2=5.4×10-5,根据图示判断,下列说法不正确的是( )

A. c点的溶液显碱性
B. a点时,加入KOH溶液的体积V1=10mL
C. b点时,溶液中各粒子浓度的大小顺序为:c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)
D. 当V(KOH)=15mL时,溶液中存在以下关系:2c(K+)=3c(C2O42-)+3c(HC2O4-)+3c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是丁烷(C4H10)裂解的实验流程。连接好装置后,需进行的实验操作有:①检置整套装置的气密性②排出装置中的空气③给D、G装置加热等……;G后面装置以及铁架台等已省略;CuO能将烃氧化成CO2和H2O。

请回答下列问题:
(1)丁烷裂解的可能方程式为C4H10![]() CH4+C3H6,____________________;
CH4+C3H6,____________________;
(2)写出甲烷与氧化铜反应的化学方程式_____________________________;
(3)若对反应后E装置中的混合物(溴水足量),再按以下流程实验:
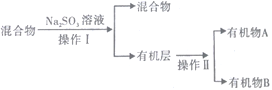
①分离操作Ⅰ和Ⅱ的名称分别是___________、___________(填字母) ;
a.蒸发 b.过滤 c.分液 d.蒸馏
②Na2SO3溶液的作用是(用离子方程式表示)_____________________________________________;
③已知A的碳原子数大于B的碳原子数,请写出B的名称______________________;
(4)假定丁烷完全裂解,流经D、G装置中的气体能完全反应。当(E+F)装置的总质量比反应前增加了0.49g,G装置的质量比反应间减少了1.44,则丁烷的裂解产物中甲烷和乙烷的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:

(1)该反应的化学方程式为_________________。
(2)0~t1s内B气体的平均反应速率为____________。
(3)(t1+10)s时,A的转化率为_____。
(4)关于该反应的说法正确的是_________。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com